软锰矿脱硫技术在国内外日益受到重视[1-4]。软锰矿中的主要成分为二氧化锰,它是一种良好的氧化剂,同时烟气中二氧化硫又是一种很好的还原剂,因此软锰矿可选作脱硫吸收剂。从工业角度考虑,软锰矿在中国价格低廉易得,但多为低品位(锰含量<25%),吸收二氧化硫后的副产品——硫酸锰又是一种很有价值的化工原料;通过这种脱硫方式,达到废气、贫矿综合利用的目的,从而实现环境效益和经济效益的绿色可循环工艺。然而脱硫吸收尾液中却存在难处理的副产物(连二硫酸锰)影响产品(硫酸锰)品质。因此,该法难以直接工业应用。
直接利用传统固相热解法去除软锰矿脱硫吸收尾液中的连二硫酸锰,其中硫酸锰和连二硫酸锰热解成四氧化三锰过程均会释放出大量的二氧化硫和三氧化硫气体,同时反应温度高达上千摄氏度,工艺耗能较大,且对仪器设备产生严重腐蚀[5]。因此,需要采用合理的工艺方式对软锰矿脱硫尾液中的副产物进行热解资源化回收。结合碳化工艺,借以固相钠盐低温热解反应(热解温度仅为200 ℃左右,且仅生成少量的二氧化硫)在克服传统热解工艺缺点的同时,与液相法相比(目前常见处理方法,存在大量耗酸,设备工艺步骤繁杂等问题[6-7]),其可行性高、生产工艺较简单、且便于工业化生产[8-10]。
通过碳酸氢钠碳化工艺,将连二硫酸锰和硫酸锰转化为连二硫酸钠和硫酸钠。反应方程式如下:
| $\begin{aligned}[b] & {\rm{Mn}}{{\rm{S}}_2}{{\rm{O}}_6} + 2{\rm{NaHC}}{{\rm{O}}_3} \xrightarrow{\quad\quad}\\ & {\rm{N}}{{\rm{a}}_2}{{\rm{S}}_2}{{\rm{O}}_6} + {{\rm{H}}_2}{\rm{O}} + {\rm{MnC}}{{\rm{O}}_3} \downarrow + {\rm{C}}{{\rm{O}}_2} \uparrow \end{aligned}$ | (1) |
| $\begin{aligned}[b] & {\rm{MnS}}{{\rm{O}}_4} + 2{\rm{NaHC}}{{\rm{O}}_3} \xrightarrow{\quad\quad} \\ & {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} + {{\rm{H}}_2}{\rm{O}} + {\rm{MnC}}{{\rm{O}}_3} \downarrow + {\rm{C}}{{\rm{O}}_2} \uparrow \end{aligned}$ | (2) |
最终,经低温热解可获得无水硫酸钠(Na2SO4),它作为一种常见试剂,广泛用于制造水玻璃、玻璃、致冷混合剂、洗涤剂、医药品、饲料、染料稀释剂及干燥剂等方面[11]。在241 ℃时硫酸钠会转变成六方型结晶可作为有机合成工艺中的后处理干燥剂[12]。
通常制备硫酸钠的传统方法多为采用滩田法、机械冷冻法和盐湖综合法,其原理为利用海水或各种硭硝矿中硫酸钠的溶解度在低温下急剧下降,从水盐平衡体系相中析出,但其中的杂质较多;而软锰矿脱硫吸收液经过除杂且热解过程会挥发灰分,杂质含量低[13-14]。
作为连二硫酸盐,连二硫酸钠的热解应与其他连二硫酸盐(连二硫酸镁[15]、连二硫酸钙[16]和连二硫酸钡[16]等)具有相似性;同时,与钠盐(碳酸钠[17]、氯化钠[18]等)具有一定的相似性。因此,从技术层面来看,连二硫酸锰碳化生成连二硫酸钠进行固相低温热解法制备硫酸钠的工艺方法是可行的。作者以连二硫酸锰作为原料,经过一系列前处理后热解制备出无水硫酸钠;并对热解过程中生成的产物及含硫尾气进行测定,实验研究了经处理后的滤液干渣(软锰矿脱硫尾液)进行低温热解制备无水硫酸钠工艺,实验表明尾气中硫氧化物主要为二氧化硫。该法具有低能耗、流程可操作性强、产物可作为工业干燥剂等优点。因此,探讨热解反应机理,旨在为软锰矿脱硫尾液中连二硫酸锰的回收利用提供新的思路和方法。
1 实验部分 1.1 实验材料将软锰矿和水按照5∶1比例进行混合,连续通入二氧化硫(25 mL/min),模拟软锰矿浆脱硫反应工艺。对反应后的吸收尾液进行降温、除杂和过滤,所得尾气吸收混合液中主要含有连二硫酸锰和硫酸锰混合液(混合液A成分见表1第1行)。按照n(碳酸氢钠)∶n(吸收液(MnS2O6))=2.3∶1进行配置碳化试剂,随后逐滴加入吸收液中进行碳化,并保持中和反应缓慢发生(反应过程中溢出大量CO2气泡),在线监测混合溶液pH值升至(6.3±0.4)且无沉淀生成(测定碳酸锰中的锰质量分数为43.2%,即为反应终点[19])停止反应,静置,得到连二硫酸钠和硫酸钠及少量的碳酸钠混合液(混合液B成分见表1第2行)。
| 表1 吸收尾液组分分析 Tab. 1 Compositions of the dithionate |
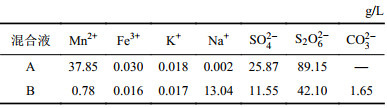 |
将上述滤液在95 ℃烘至析出少量结晶,后冷冻干燥,所得混合物粉末研磨后过100目筛作为原料待用(以下称其为滤液干渣)。实验用水均为蒸馏水。
1.2 实验装置实验装置流程如图1所示,整个装置由3个部分组成,分别是吹扫装置、程控箱式电阻炉和尾气吸收装置。实验中以氮气作为载气,流速控制在200 mL/min。利用氮气进行吹扫过程,目的是排出反应器和管道中的空气以及热解后产生的尾气;程控箱式电阻炉(型号SX–G12)是实验装置的核心部分,为天津中环电炉厂生产;吸收装置由两个多孔板式吸收瓶(1级吸收瓶是一定浓度的氨基磺酸氨,2级吸收瓶是氢氧化钠和双氧水混合液)组成,用于吸收热解尾气并确定其组分。电炉与氮气钢瓶和吸收瓶进出口通过聚四氟乙烯软管连接。
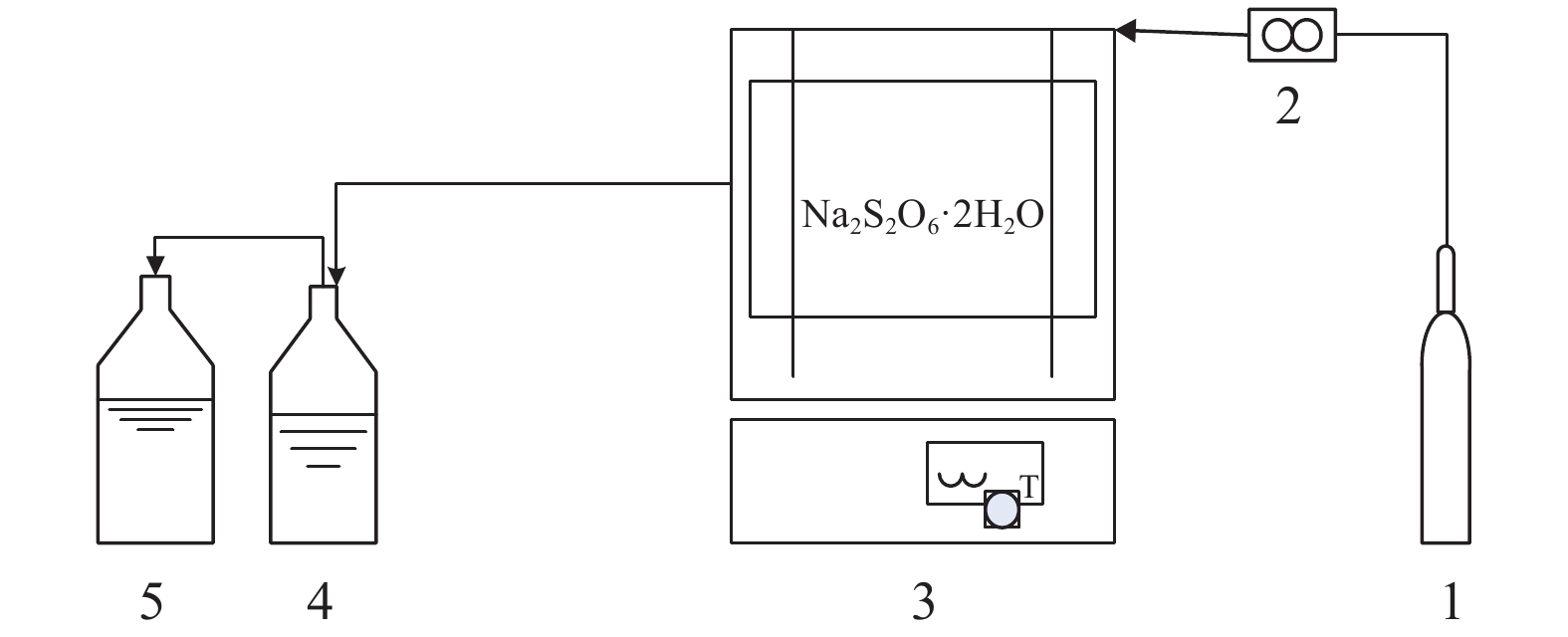 |
| 1. 氮气钢瓶;2. 流量计;3. 箱式电阻炉; 4. 1级吸收瓶;5. 2级吸收瓶。 图1 热解实验装置 Fig. 1 Experiment apparatus |
1.3 实验方法 1.3.1 硫酸钠的制备和热解尾气的测定步骤
将滤液干渣在不同温度下煅烧60 min,结合XRD分析反应产物的物相组成;筛选出适合制备无水硫酸钠的最佳热解温度。在此反应条件下,利用滤液干渣制备无水硫酸钠晶体;同时用含有稳定剂的氨基磺酸氨吸收液吸收热解尾气中的二氧化硫;利用湿润(含碘液–碘量法)的棉花进行三氧化硫吸附,尾气吸收完成后通过测定吸收液中的硫酸根和亚硫酸根的浓度确定出尾气中所含的二氧化硫或三氧化硫生成量。
1.3.2 分析测试方法热解反应前后物质固相检测和液相吸收尾气组分分析:金属离子用电感耦合等离子体质谱(ICP–MS,Perkin Elmer Nexion300)进行检测;采用综合热重示差热分析仪(TG–DSC,Netzsch STA499C)分析固相热分解过程中失重情况与升温时间的关系,用以研究物质的热稳定性和组分;用X射线衍射仪(XRD,Philips X’pert MPD)鉴定固态物相组分;利用离子色谱(IC,Dionex ICS–2500)和碘量法(HJ/T 56–2000)测定液相中的碳酸根、硫酸根和亚硫酸根离子。
1.4 动力学模型热分解动力学的基本理论是在等温过程和均相反应基础上建立的,作为研究固相物质在热解过程中分解速率问题手段[20]。对于热解反应过程中,若转变分数设定为a,则从反应开始到结束的整个周期内,a∈(0~1)且单调变化。在等温条件下,基元反应分解速率的微分和积分表达形式分别为:
| ${\text{微分形式:}}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\frac{{{\rm d}a}}{{{\rm d}t}} = kF(a)\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;$ | (3) |
| $ {\text{积分形式:}}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;G(a) = kt\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; $ | (4) |
式中:F(a)为微分形式的动力学机理函数;G(a)为积分形式的动力学机理函数;a为转变分数,a∈(0~1);k为反应速率常数,
非等温动力学是目前热分解动力学的核心。与传统的等温动力学相比非等温动力学更为简洁快速,一条非等温热分析曲线可以包含并替代多条等温曲线的数据和信息,且计算结果可靠度更高[21]。动力学研究的目的是通过求解得出动力学3因子,即活化能Ea、指前因子A和机理函数。
用常见的Kissinger微分法[22-23]和Coats–Redfern积分法[24]作为非等温动力学模型求解动力学3因子中的Ea。此时,利用不同升温速率
Kissinger微分法为:
| $\ln \left[ {\frac{{F\left( a \right)}}{{T - {T_0}}}} \right] = \ln \frac{A}{\beta } - \frac{E}{{RT}}$ | (5) |
对于非等温体系,反应是在程序控制升温速率
| $\frac{{{\rm d}a}}{{{\rm d}t}} = \frac{A}{\beta }F(a){{\rm e}^{\tfrac{{ - {E_{\rm{a}}}}}{{RT}}}}$ | (6) |
式中,
考虑到固相热分解反应中,变化速率da/dT与转变分数a之间有更为复杂的函数关系。因此假设DSC峰顶处为最大反应速率发生的位置,与之相对应的温度为Tp,根据式(6),当n=1,在Tp处对温度取2阶导数并令d2a/dT2=0,则:
| $\frac{E}{{R{T^2}}} = \frac{A}{\beta }{{\rm{e}}^{\tfrac{{ - E}}{{RT}}}}$ | (7) |
将式(7)移项后取对数,再两边同时对1/Tp微分可得:
| $\frac{{{\rm d}\left[ {\ln \left( {\dfrac{\beta }{{{T^2}}}} \right)} \right]}}{{{\rm d}\left( {\dfrac{1}{{{T_{\rm{p}}}}}} \right)}} = - \frac{E}{R}$ | (8) |
Coats–Redfern积分法分离变量,并积分简化得式(9):
| $\ln \left[\frac{{G{\rm{(}}a{\rm{)}}}}{{{T^2}}}\right] = \ln \left[\frac{{A{\rm{R}}}}{{\beta E}}\right] - \frac{E}{RT}$ | (9) |
对其进一步积分得,设
| $\lg P(X ) = - 2.315 + 0.456\;7X$ | (10) |
式中,X为定义函数。
结合积分简化,可得:
| $\lg\;\beta = \lg \frac{{AE}}{{RG(a)}} - 2.315 + 0.456\;7\frac{E}{{T{{R}}}}$ | (11) |
式中,T为升温速率,是
升温速率为5 K/min时,连二硫酸钠在25~500 ℃的TG–DSC曲线如图2所示。从图2可以看出,连二硫酸钠在温度升高过程中存在两个明显的失重过程,分别开始于74.5 ℃和268.4 ℃。第1阶段的失重率14.44%和第2阶段的失重率24.61%分别与连二硫酸钠完全脱水(14.87%)和连二硫酸钠分解生成硫酸钠(31.05%)以及碳酸钠吸收二氧化硫(4.82%)的理论失重率及增重率范围值近似。当温度高于300 ℃时,TG曲线趋于平稳,说明连二硫酸钠热解完成,转化成为一种新的热稳定的物质。DSC曲线中有2个明显的吸热峰,峰出现的温度范围分别在50.5~90.5 ℃和249.6~280.9 ℃的范围,对应峰值分别为74.5和268.4 ℃。结合对TG曲线的分析可以推断,在25~100 ℃之间为二水合连二硫酸钠的脱水阶段,脱水后转化成无水连二硫酸钠;在250~300 ℃之间的失重和吸热峰是无水连二硫酸钠的进一步分解导致,根据失重率数据可以推断热解产物应为硫酸钠。
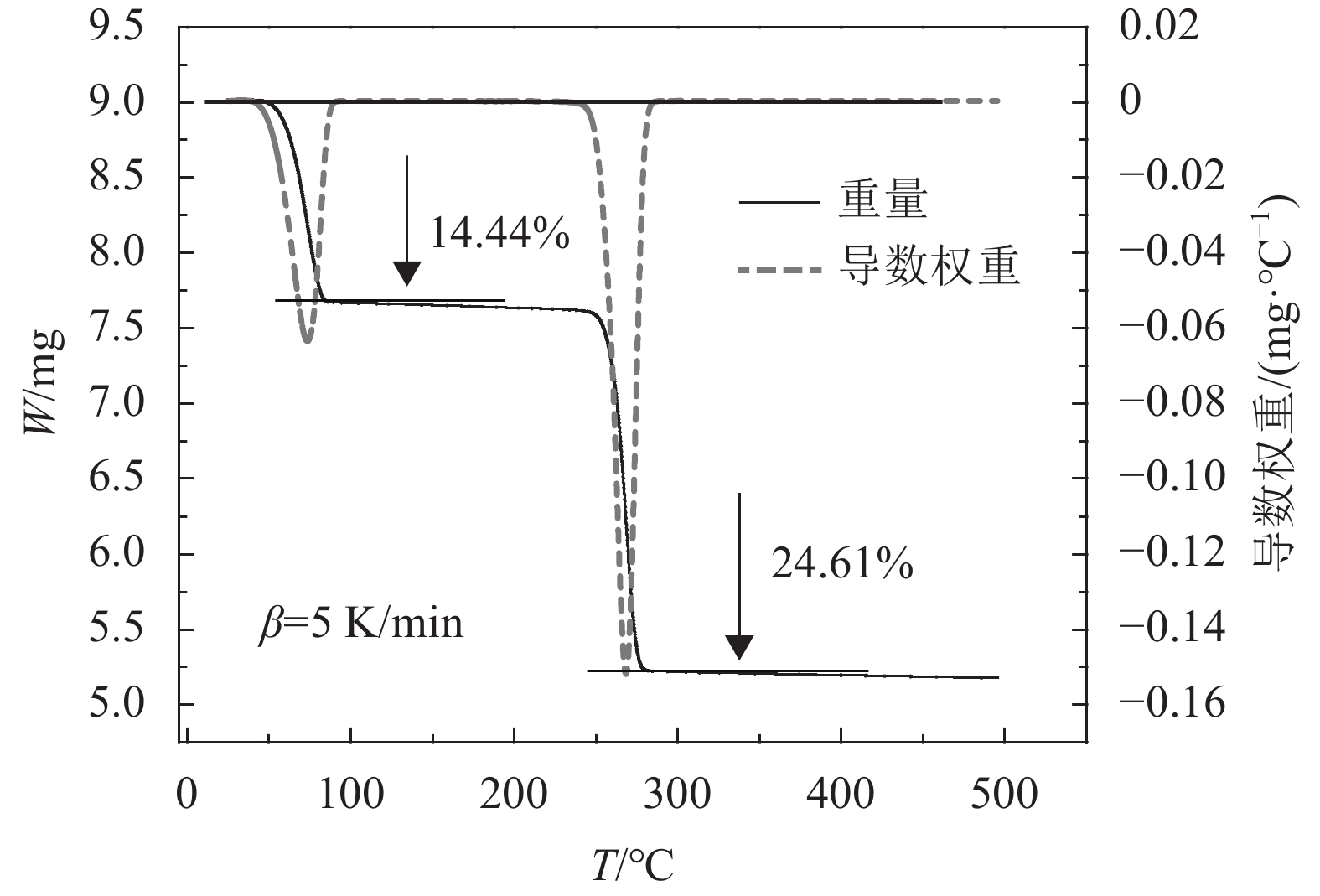 |
| 图2 连二硫酸钠的TG–DSC分析曲线 Fig. 2 TG–DSC analysis curve of sodium dithionate |
图3是通过实验测得的2.0 g二水连二硫酸钠在不同温度下焙烧60 min后的失重率变化,图3中有两条水平直线分别是二水合连二硫酸钠脱水、分解脱硫成硫酸钠的理论失重率。
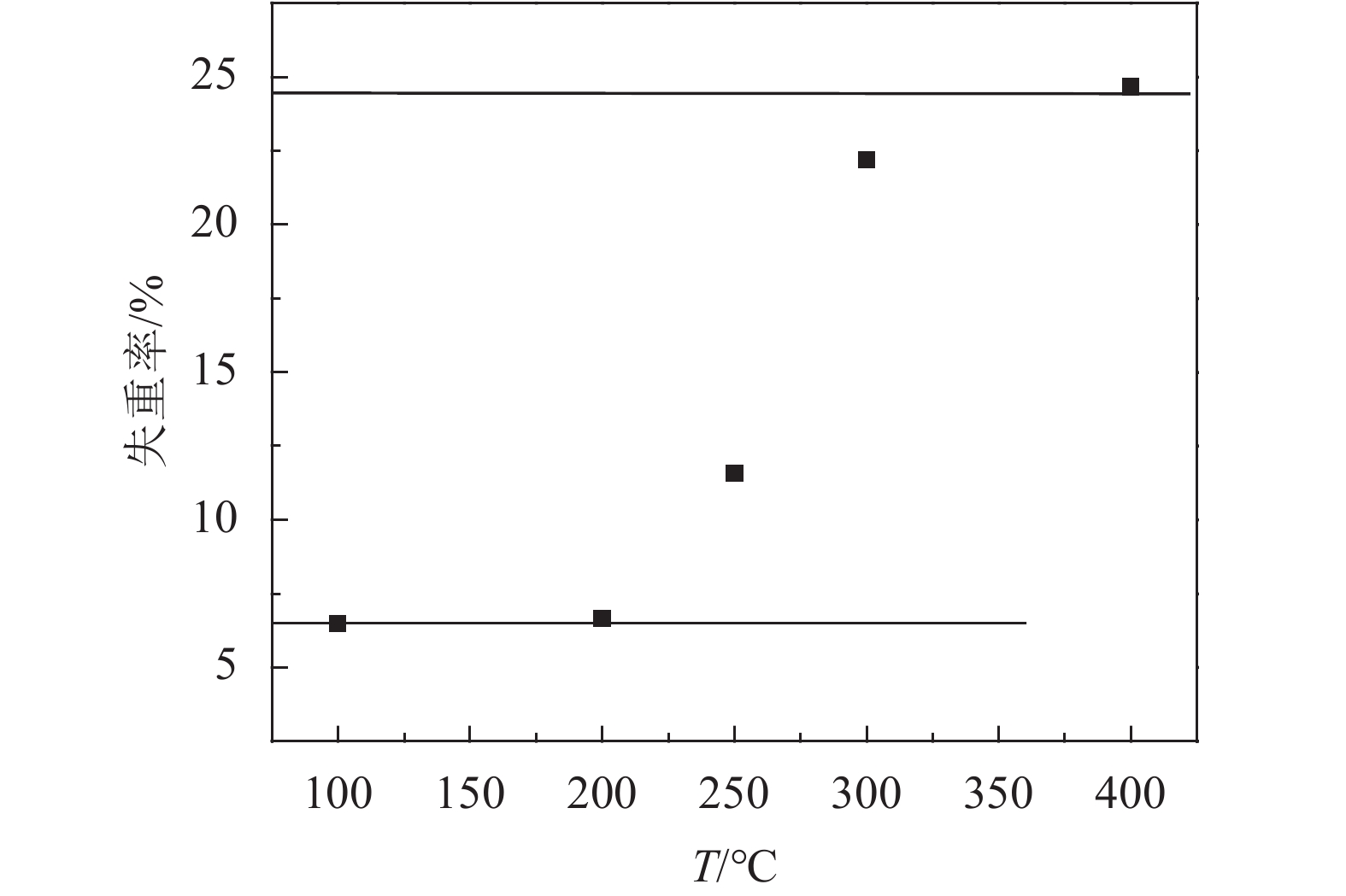 |
| 图3 不同温度下焙烧60 min后连二硫酸钠样品的失重率 Fig. 3 Weight loss of samples after 60 minutes calcination |
结合TG–DSC曲线分析图2和实验测定的失重率变化分析(图3)可以大致确定二水合连二硫酸钠的两个热分解阶段分别在60~150 ℃和240~330 ℃。
图4是连二硫酸钠分别在100、200、250和300 ℃的温度下焙烧60 min后产物的XRD图谱。
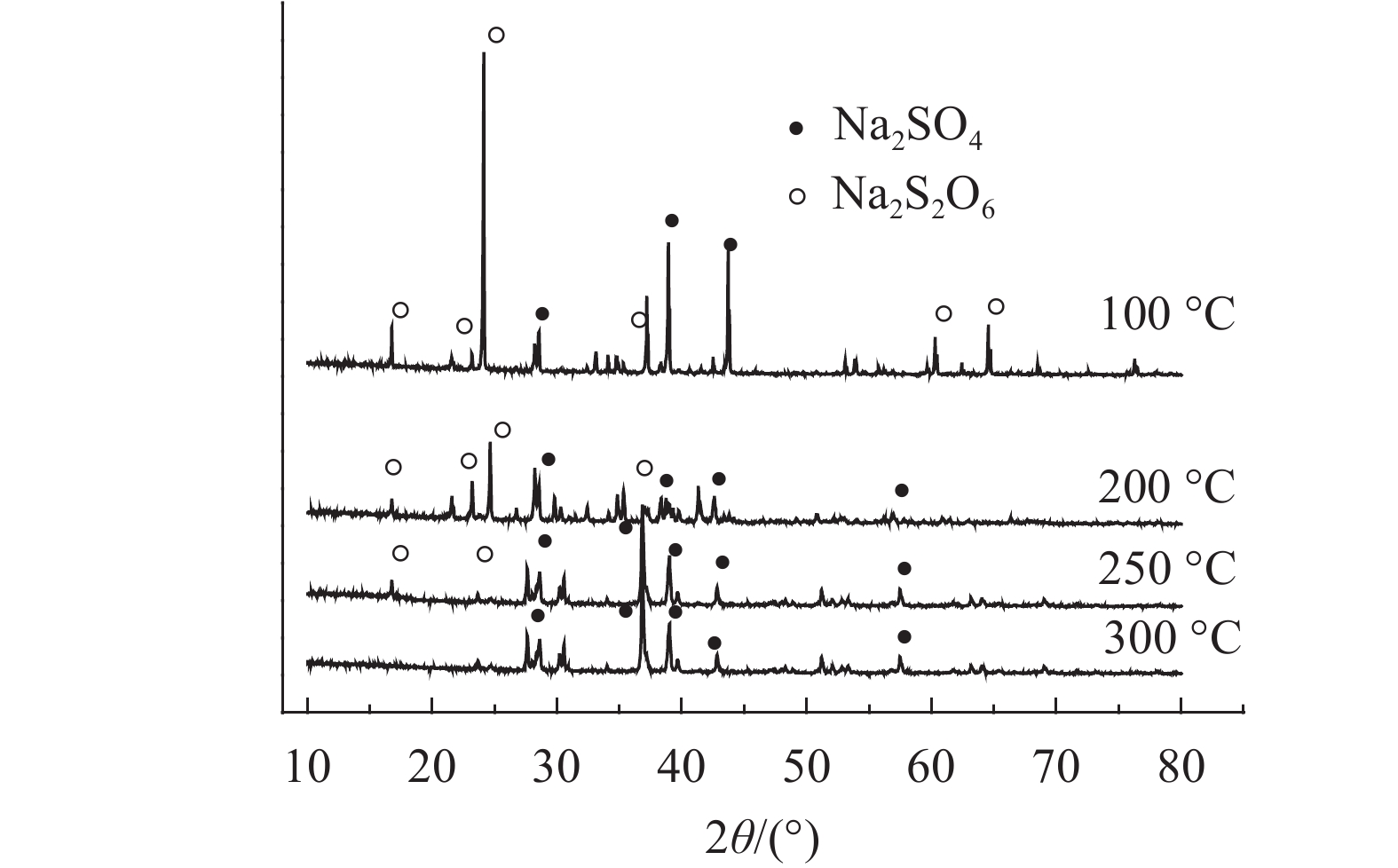 |
| 图4 不同温度下连二硫酸钠焙烧60 min后产物的XRD图谱分析 Fig. 4 XRD patterns of products obtained by different heating temperatures |
通过XRD的分析结果(图4)可以确定:1)300 ℃时的最终热解产物为硫酸钠。根据TG–DSC分析结果,热解无水连二硫酸钠开始分解的温度应该在255 ℃左右;图4的实验结果进一步证实250 ℃时连二硫酸钠会分解生成无水硫酸钠,因此可以通过对250~300 ℃时焙烧足够长时间后所得产物进行物相鉴定,当硫酸钠开始生成时对应的温度即为无水连二硫酸钠开始热解的温度;2)二水合连二硫酸钠在温度80 ℃时分解生成连二硫酸钠。因此连二硫酸钠低温热解的控制步骤及产物组分,见表2。
| 表2 连二硫酸钠在低温下的热解过程 Tab. 2 Thermal decomposition procedure of Na2S2O6·2H2O |
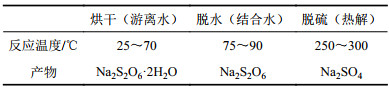 |
2.2 连二硫酸钠低温热解动力学研究
连二硫酸钠分解过程受热传质影响相对较小,反应温度较低,通过用TG–DSC热分析数据进行非等温动力学计算。
2.2.1 Kissinger法求解活化能根据连二硫酸钠在不同升温速率下的TG–DSC曲线,可以得到峰值温度,如表3所示。
| 表3 Kissinger法下不同升温速率的DSC曲线峰值关系 Tab. 3 Peak value relation of DSC obtained by different convert ratios using Kissinger method |
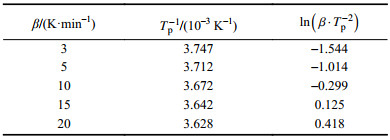 |
根据表3绘制
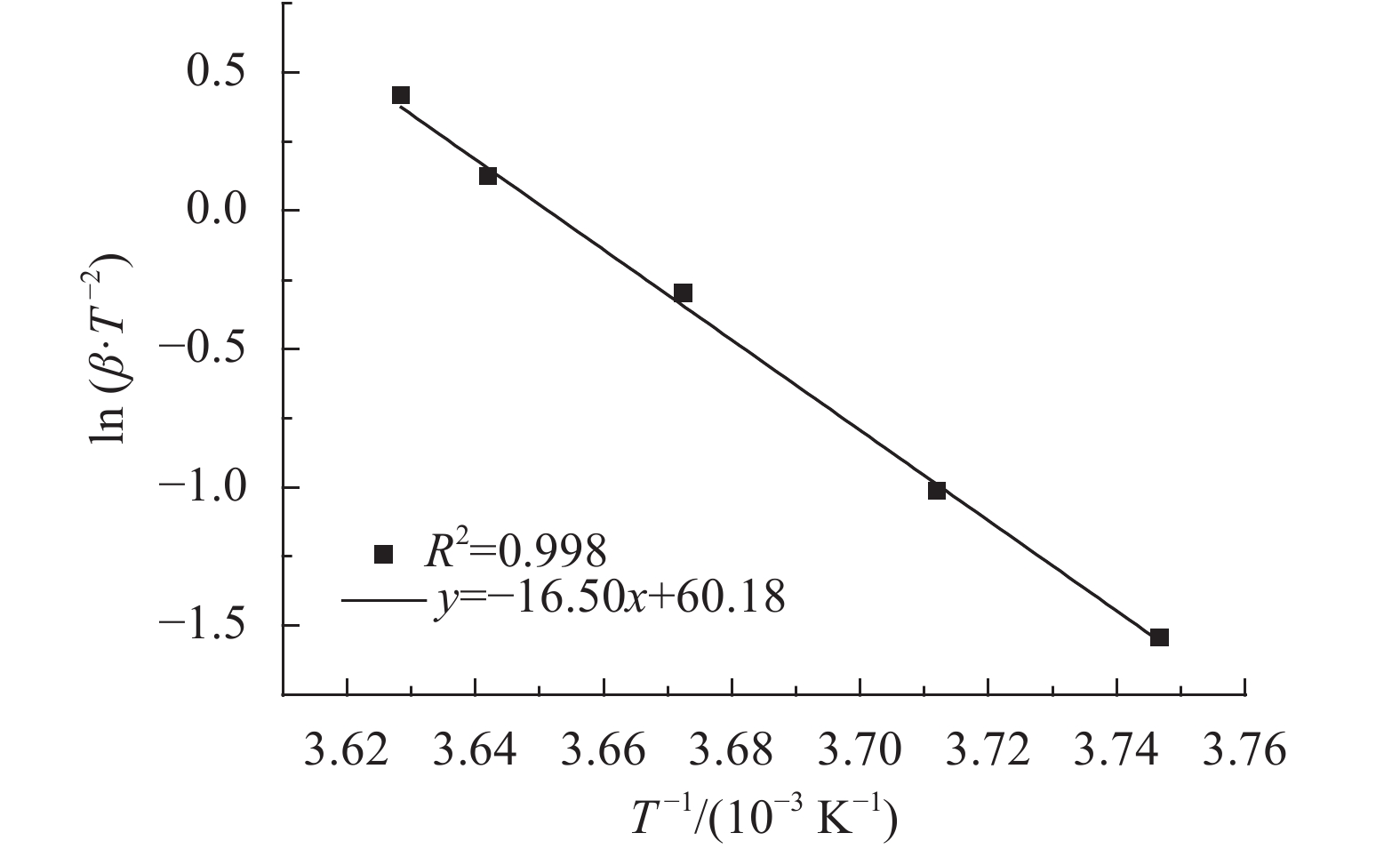 |
|
图5 Kissinger法下连二硫酸钠热解的ln
|
| $\ln\left(\frac{\beta }{T\!_p^2}\right) = - \frac{E}{{{R}}} \times \frac{1}{T} + \ln\; {A_0}$ | (12) |
由上述分析结果,可以进一步得到连二硫酸钠热分解的活化能:
同理,脱水的活化能:
计算连二硫酸钠热分解反应所得的活化能过程中,回归线性方程的相关系数绝对值非常接近1,表明实验数据具有良好的相关性[25-26]。
2.2.2 Coats–Redfern法求解活化能在不同升温速率下得到的若干条热重曲线,都取转变分数a的某一特定值对应的T,做
| 表4 Coats–Redfern法下不同升温速率下的DSC曲线峰值关系 Tab. 4 Peak value relation of DSC obtained by different convert ratios using Coats–Redfern method |
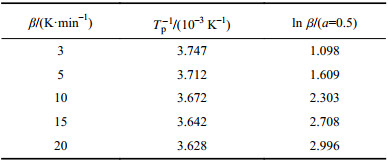 |
根据以上数据分别计算
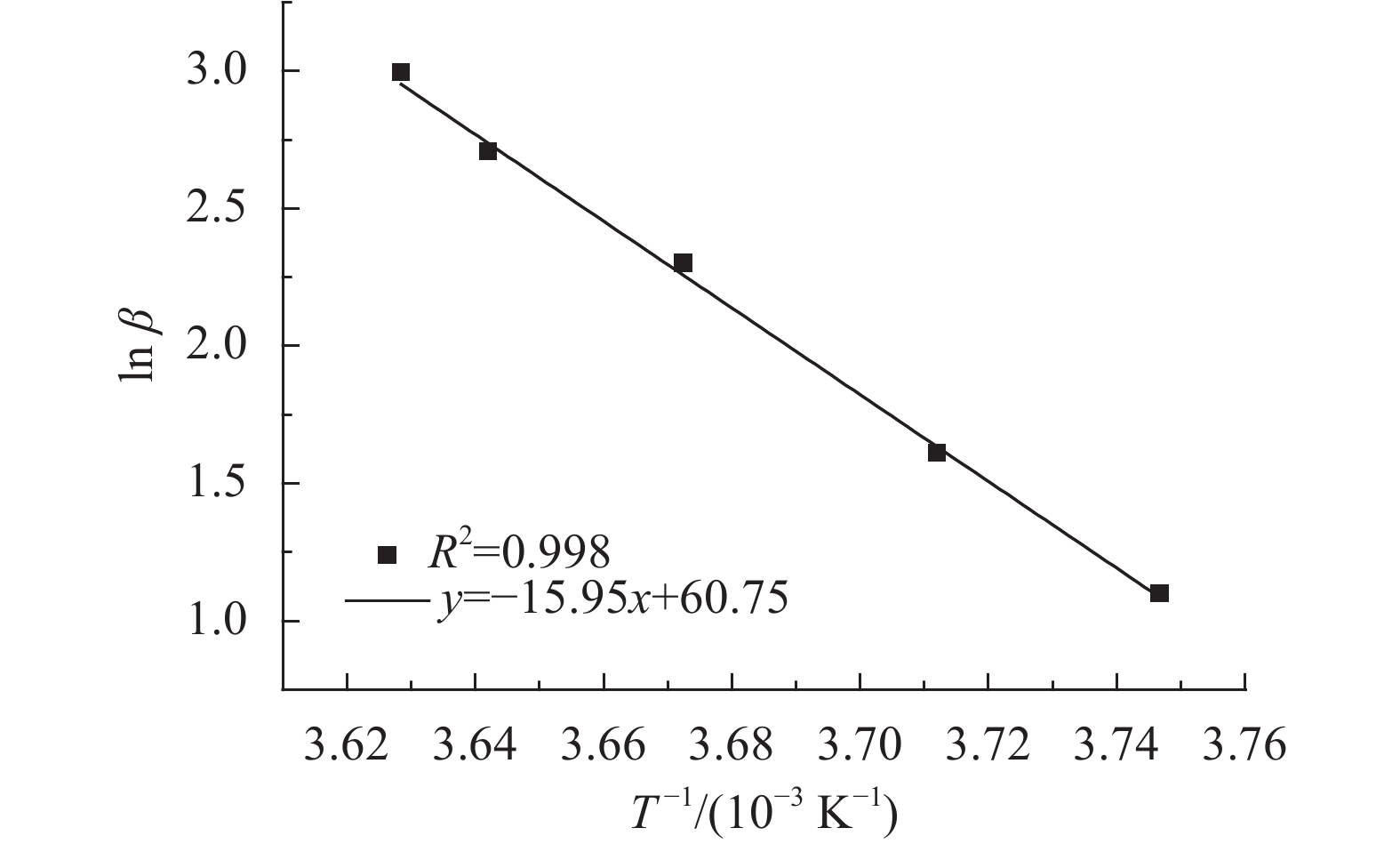 |
|
图6 Coats–Redfern法下的连二硫酸钠热解的ln
|
| $\ln\;\beta = - \frac{E}{R} \times \frac{1}{T} + \ln \;{A_0}$ | (13) |
由上述分析结果,可以进一步得到连二硫酸钠热分解的活化能:
同理,脱水的活化能:
活化能计算结果表明:脱水阶段的活化能随转化率增加而降低,说明脱水过程随着转化率升高越容易进行。热解过程的活化能随着转化率的升高呈先增加到稳定的趋势,但是整体变化幅度较小,且热解脱硫过程活化能远大于脱水过程活化能。说明热解脱硫过程比脱水过程更难进行。
2.3 滤液干渣热解尾气组分的分析滤液干渣在热解过程中会释放出二氧化硫和水蒸汽气体。在低温无氧且无催化离子存在的条件下,生成的二氧化硫被氧化成三氧化硫气体可能性较低。
取原料滤液干渣混合物2.0 g热解制备硫酸钠。在箱式炉内以不同温度进行热分解,可收集到二氧化硫和三氧化硫(可能存在),计算出各自占滤液干渣中硫元素的百分比,所得实验结果如表5所示。
| 表5 连二硫酸钠热解尾气测定结果 Tab. 5 Decomposition gas analysis of the thermal decomposition of Na2S2O6·2H2O |
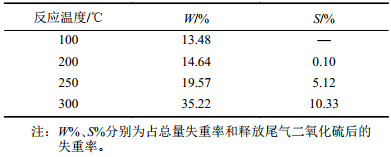 |
由表5可见,硫溢出(形成硫氧化物)的起始温度高于200 ℃;在300 ℃恒温30 min,硫基本完成分解。在不同恒温条件下,将混合物热分解60 min后的残余物分别进行XRD分析[27],结果如图4所示。实验结果表明:热解产物与热解尾气存在一定的符合关系。
综合各测定结果可推导出反应机理,其包括以下反应过程:
| ${\rm{N}}{{\rm{a}}_2}{{\rm{S}}_2}{{\rm{O}}_6}\cdot2{{\rm{H}}_2}{\rm{O}} \xrightarrow{\quad\quad} {\rm{N}}{{\rm{a}}_2}{{\rm{S}}_2}{{\rm{O}}_6} + 2{{\rm{H}}_2}{\rm{O}} \uparrow $ | (14) |
| ${\rm{N}}{{\rm{a}}_2}{{\rm{S}}_2}{{\rm{O}}_6} \xrightarrow{\quad\quad} {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} + {\rm{S}}{{\rm{O}}_2} \uparrow $ | (15) |
由此推得总反应为:
| ${\rm{N}}{{\rm{a}}_2}{{\rm{S}}_2}{{\rm{O}}_6}\cdot2{{\rm{H}}_2}{\rm{O}} \xrightarrow{\quad\quad} {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} + 2{{\rm{H}}_2}{\rm{O}} \uparrow + {\rm{S}}{{\rm{O}}_2} \uparrow $ | (16) |
结合碳化、热解工艺旨在对软锰矿和二氧化硫反应液中的连二硫酸锰进行资源化回收,并系统地研究了低温热解反应工艺的热解温度、热解产物、动力学参数和反应机理。最终,得到了以下结论:
1)软锰矿脱硫吸收尾液经碳酸氢钠碳化可得到的硫酸钠、连二硫酸钠和碳酸锰,经分离、烘干及低温热解滤液干渣(二水合连二硫酸钠+硫酸钠)可得到纯度较高的无水硫酸钠固体和少量二氧化硫气体。
2)滤液干渣在热解温度升高时经历两个分解过程,分别是二水合连二硫酸钠的脱水和无水连二硫酸钠的热分解。二水合连二硫酸钠的脱水开始于80 ℃,产物为无水连二硫酸钠;无水连二硫酸钠在温度高于250 ℃时开始热分解,产物为无水硫酸钠。固相热解温度越高,无水连二硫酸钠热解生成无水硫酸钠的速率越快,越容易热分解。
3)选用Kissinger微分法和Coats–Redfern积分法两种常见热分析动力学模型对二水合连二硫酸钠脱水和无水连二硫酸钠脱硫的热解动力学进行了研究,分别得出了其脱水和脱硫动力学3因子中活化能Ea。其热解反应各阶段的Ea分别为:二水连二硫酸钠脱水:E1=14.75~18.11 kJ/mol;无水连二硫酸钠脱硫:E2=132.61~137.18 kJ/mol。
二水合连二硫酸钠脱水时的活化能小于脱硫时活化能,表明二水合连二硫酸钠脱水反应较热解脱硫反应更为容易进行。
| [1] |
Su Shijun,Zhu Xiaofan,Liu Yongjun,et al. A pilot-scale jet bubbling reactor for wet flue gas desulfurization with pyrolusite[J]. Journal of Environmental Sciences, 2005, 17(5): 827-831. DOI:10.3321/j.issn:1001-0742.2005.05.025 |
| [2] |
Sun Weiyi,Ding Sanglan,Su Shijun,et al. Leaching kinetics of Mn from low grade pyrolusite with SO2 in liquid phase
[J]. Journal of Sichuan University(Engineering Science Edition), 2011, 42(Supp1): 199-203. [孙维义,丁桑岚,苏仕军,等. 二氧化硫液相浸取低品位软锰矿的动力学[J]. 四川大学学报(工程科学版), 2011, 42(增刊1): 199-203.] |
| [3] |
Lin Qingquan,Gu Guohua,Wang Hui,et al. Preparation of manganese sulfate from low-grade manganese carbonate ores by sulfuric acid leaching[J]. International Journal of Minerals Metallurgy and Material, 2016, 23(5): 491-500. DOI:10.1007/s12613-016-1260-x |
| [4] |
Cai Zhenlei,Feng Yali,Li Haoran,et al. Co-recovery of manganese from low-grade pyrolusite and vanadium from stone coal using fluidized roasting coupling technology[J]. Hydrometallurgy, 2013, 131(32): 40-45. DOI:10.1016/j.hydromet.2012.10.002 |
| [5] |
Shen Wu,Liao Bing,Sun Weiyi,et al. Preparation of Mn2O3 by thermal decomposition of MnSO4 conbined with reductive leaching of low grade pyrolusite using the decomposition gas
[J]. Journal of Sichuan University(Engineering Science Edition), 2014, 46(2): 177-181. [申武,廖兵,孙维义,等. 硫酸锰热解制备Mn2O3以及用热解尾气浸出低品位软锰矿的实验研究
[J]. 四川大学学报(工程科学版), 2014, 46(2): 177-181.] |
| [6] |
Qu Bing,Hu Wenli,Deng Lin,et al. Simultaneous determination of dithionate and sulfate in leaching solution from SO2–leaching pyrolusite by ion chromatography
[J]. Energy & Fuels, 2016, 30(10): 8561-8566. DOI:10.1021/acs.energyfuels.6b01333 |
| [7] |
Chow N,Nacu A M,Warkentin D,et al.Processing of manganous sulphate/dithionate liquors derived from manganese resource material:USA8460631[P].2013–05–22.
|
| [8] |
Han Zuozhen,Zhuang Dingxiang,Zhao Hui,et al. Thermogravimetric and kinetic analysis of thermal decomposition characteristics of microbial calcites induced by cyanobacteria Synechocystis PCC6803[J]. Journal of Thermal Analysis and Calorimetry, 2017, 20(127): 1-9. DOI:10.1007/s10973-016-6026-1 |
| [9] |
Zhong Yiwei,Gao Jintao,Chen Panze,et al. Recovery of potassium from K-feldspar by thermal decomposition with flue gas desulfurization (FGD) gypsum and CaCO3:Analysis of mechanism and kinetics
[J]. Energy & Fuels, 2017, 31(1): 699-707. DOI:10.1021/acs.energyfuels.6b01915 |
| [10] |
Adewale R,Salem D J,Berrouk A S,et al. Simulation of hydrogen production from thermal decomposition ofhydrogen sulfide in sulfur recovery units[J]. Journal of Cleaner Production, 2016, 112(5): 4815-4825. DOI:10.1016/j.jclepro.2015.08.021 |
| [11] |
Jiang Qin,Gao Guanghua,Yu Yangxin,et al. Solubility of sodium dimethyl isophthalate–5–sulfonate in water and in water-methanol containing sodium sulfate[J]. Journal of Chemical & Engineering Data, 2000, 45(2): 292-294. DOI:10.1021/je990167b |
| [12] |
Chang K W,Kuo C Y. 6–Gingerol modulates proinflammatory responses in dextran sodium sulfate (DSS)-treated Caco-2 cells and experimental colitis in mice through adenosine monophosphate-activated protein kinase (AMPK) activation[J]. Food & Function, 2015, 6(10): 33-34. DOI:10.1039/c5fo00513b |
| [13] |
Xu Jianmin,Hou Huizhen. Studies on organo-mineral complexes in soil. Ⅷ .Sodium sulphate as extractant to separate calcium-bound organo-mineral[J]. Acta Pedologica Sinica, 1998, 38(4): 468-474. [徐建民,侯惠珍. 土壤有机矿质复合体研究:Ⅷ.分离钙键有机矿质复合体的浸提剂——硫酸钠[J]. 土壤学报, 1998, 38(4): 468-474. DOI:10.3321/j.issn:0564-3929.1998.04.005] |
| [14] |
傅立德,彭美桂.一种制备无水硫酸钠的设备和方法:CN201610069549.5[P].2016–04–13.
|
| [15] |
House J E Jr,Jeyaraj G L,Engel D A,et al. Thermal studies on dithonate compunds.Ⅱ.Dithonate of lithium,sodium,and magnesium[J]. Thermochimica Acta, 1983, 70(5): 189-193. DOI:10.1016/0040-6031(83)80067-7 |
| [16] |
House J E Jr,Jeyaraj G L. Thermal studies on dithionate compounds dithionates of cobalt(Ⅱ),nickel(Ⅱ),copper(Ⅱ),zinc(Ⅱ) and cadmium(Ⅱ)[J]. Journal of Thermal Analysis, 1984, 29(3): 41-48. |
| [17] |
Ye Jiewang,Jin Chunde,Song Ping’an,et al. Pyrolusis kinetics of alkali lignin catalyzed by sodium carbonate[J]. Chemistry and Industry of Forest Products, 2010, 30(6): 40-44. [叶结旺,金春德,宋平安,等. 碳酸钠催化碱木质素的热解动力学研究[J]. 林产化学与工业, 2010, 30(6): 40-44.] |
| [18] |
Wada T,Koga N. Kinetics and mechanism of the thermal decomposition of sodium percarbonate:Role of the surface product layer[J]. Journal of Physical Chemistry(A), 2013, 117(9): 1880-1885. DOI:10.1021/jp3123924 |
| [19] |
Wang Bozhi,Su Shijun,Ding Sanglan,et al. Research on preparation of manganese carbonate using pyrolusite pulp desulfurization absorption solution[J]. Hydrometallurgy of China, 2018, 20(2): 148-151. [王博知,苏仕军,丁桑岚,等. 用软锰矿矿浆脱硫吸收液制备碳酸锰[J]. 湿法冶金, 2018, 20(2): 148-151.] |
| [20] |
Zhang G,Zhao X,Ning P. Comparison on surface properties and desulfurization of MnO2 and pyrolusite blended activated carbon by steam activation
[J]. Journal of the Air & Waste Management Association, 2018, 68(9): 958-968. DOI:10.1080/10962247.2018.1460636 |
| [21] |
Zhang Shengchun,Hang Zusheng,Tan Linghua. Study of thermal decomposition of poly (phenylene oxide) by non-isothermal thermogravimetry[J]. Modern Plastics Processing and Applications, 2011, 23(2): 40-43. [张声春,杭祖圣,谈玲华. 非等温热重法研究聚苯醚热分解动力学[J]. 现代塑料加工应用, 2011, 23(2): 40-43. DOI:10.3969/j.issn.1004-3055.2011.02.012] |
| [22] |
Sánchez–Jiménez P E,Criado J M,Pérez–Maqueda L A. Kissinger kinetic analysis of data obtained under different heating schedules[J]. Journal of Thermal Analysis & Calorimetry, 2008, 94(2): 427-432. DOI:10.1007/s10973-008-9200-2 |
| [23] |
Budrugeac P,Segal E. Applicability of the kissinger equation in thermal analysis[J]. Journal of Thermal Analysis & Calorimetry, 2007, 88(3): 703-707. DOI:10.1007/s10973-006-8087-z |
| [24] |
Lu Lingang,Zhang Qing,Xu Xiaonan,et al. The kineris of thermal degradation of a halogen-free flame-retarded polypropylene[J]. Polymer Materials Science and Engineering, 2010, 26(11): 39-43. [卢林刚,张晴,徐晓楠,等. 一种无卤阻燃聚丙烯的热分解动力学[J]. 高分子材料科学与工程, 2010, 26(11): 39-43.] |
| [25] |
王松桂.线性模型的理论及其应用 [M].合肥:安徽教育出版社,1987:25–44.
|
| [26] |
约翰·内特,威廉·沃塞曼,等.应用线性回归模型[M].北京:中国统计出版社,1990:15–33.
|
| [27] |
Antolini E,Cardellini F. Formation of carbon supported PtRu alloys:An XRD analysis[J]. Journal of Alloys & Compounds, 2001, 315(12): 118-122. DOI:10.1016/S0925-8388(00)01260-3 |
 2020, Vol. 52
2020, Vol. 52


