2. 中国铁工投资建设集团有限公司,北京 101300;
3. 四川大学 水力学与山区河流开发保护国家重点室,四川 成都 610065;
4. 四川大学 水利水电学院,四川 成都 610065
2. China Tiegong Investment & Construction Group Co., Ltd., Beijing 101300, China;
3. State Key Lab. of Hydraulics and Mountain River Eng., Sichuan Univ., Chengdu 610065, China;
4. College of Water Resource and Hydropower, Sichuan Univ., Chengdu 610065, China
土壤污染调查显示中国土壤的点位超标率达到了19.4%,其中,镉的点位污染率最高,达到7%[1];研究指出中国被镉污染的农田已经达到了1.3×105 km2[2]。在农田土壤重金属污染修复技术中,原位钝化剂修复技术应用最广泛[3],由于土壤污染的不均匀性和复杂性,限制了该技术的发展。将黏土矿物、腐植酸等土壤胶体中重要的功能组分作为钝化物质添加到农田土壤中,通过提高土壤胶体本身对污染物的吸附容量来控制污染物从土壤到植物中的迁移,达到安全、长效、适用性广的目的。
蒙脱石(montmorillonite,Me)是土壤中重要的黏土矿物成分之一,对土壤的性质起关键的作用,其比表面积大,阳离子交换性能和吸附容量较高,可有效吸附土壤中的重金属,以达到对土壤的净化作用[4]。胡敏酸(humic acid,HA)是腐植酸的重要组成部分,而腐植酸是土壤有机胶体中最重要的组成成分之一[5]。胡敏酸表面所带的羧基、羟基等作用官能团,使胡敏酸具有弱酸性、氧化还原和络合能力,可以作为良好的吸附剂应用于重金属污染物的修复治理。胡敏酸的分子量分布可以从几百道尔顿(Da)到上百万道尔顿,不同来源的胡敏酸其分子量也不同[6-8]。
已有研究发现胡敏酸的加入可以改变黏土矿物表面的性质,使蒙脱石吸附镉的含量和稳定性都发生不同程度的改变[8-10]。不同分子量组分胡敏酸中官能团的种类和数量以及空间结构都存在一定的差异,从而影响蒙脱石与胡敏酸的结合方式,同时影响胡敏酸与镉的结合方式。在蒙脱石–胡敏酸体系中,大分子胡敏酸易受到疏水作用而吸附到蒙脱石上,而小分子胡敏酸会滞留在反应液中[11-12];Tan[13]研究发现蒙脱石中的硅醇基(Si–OH)选择吸附高分子量的胡敏酸,而铝醇基(Al–OH)则更倾向于吸附低分子量胡敏酸。在胡敏酸–镉体系中,Ni[14]、Bai[15]等研究发现含有酸性官能团的小分子量组分更易与镉进行结合;而Kozyatnyk等[16]研究表明大分子量的胡敏酸对镉具有更高的络合稳定常数和配位数,胡敏酸的芳构化程度越复杂其络合的稳定性越强;也有研究表明胡敏酸对土壤中镉的吸附和解吸与胡敏酸分子量大小不存在线性关系[17]。而在蒙脱石–胡敏酸–镉三元复合体系中,不同分子量胡敏酸对体系吸附镉的影响的研究比较欠缺,因此作者研究了不同分子量胡敏酸对蒙脱石体系吸附镉的影响及作用机制,该研究对研发高效、安全、适用性广的天然无机–有机复合钝化剂有着重要指导意义。
1 实验与材料实验中,使用的蒙脱石原样中蒙脱石含量为60%~70%,购买于山东省济南市历城化工。实验前,将蒙脱石原样进行提纯、钠化[18-19]。腐植酸原样中腐植酸的含量大于40%,购买于光复精细化工研究所,实验前,采用腐植酸协会(International Humic Substance Society,IHSS)规定的碱溶酸沉淀法从腐植酸原样中提取胡敏酸[20]。不同浓度的镉溶液由硝酸镉(分析纯)配置。其他常用化学试剂购买于各试剂厂,均属于分析纯度,使用的水均为去离子水;实验过程中设置平行样和空白样。
1.1 胡敏酸的分级超滤法因其操作简单、时间较短,在胡敏酸的分子量分级过程中得到了广泛的应用。超滤分为平流和切向流超滤(tangential flow ultrafiltration,TFU),为提高分级效率,获取足够的实验样品,采用的是切向流超滤[15,21],分级后的胡敏酸分子量大小分别为:HA1:<10 kDa;HA2:10~50 kDa;HA3:50~100 kDa;HA4:>100 kDa。
1.2 不同分子量胡敏酸对蒙脱石–胡敏酸体系吸附镉的影响实验称取0.2 g蒙脱石于离心管中,加入Cd2+溶液10 mL(浓度为0、5、20、40、100 mg/L,0.01 mol/L硝酸钠为背景溶液),调节pH为7.0,室温振荡(200 r/min)24 h后加入浓度为2 g/L不同分子量的胡敏酸溶液10 mL(pH=7),振荡24 h,然后离心过0.45 μm膜放置于4 ℃冰箱待测,实验样品分别记为(Me–Cd)+HA1、(Me–Cd)+HA2、(Me–Cd)+HA3、(Me–Cd)+HA4。
1.3 分析与表征方法镉的形态分析采用BCR连续提取方法[22]。采用元素分析仪(Euro EA3000)测定胡敏酸中C、H、N、S含量,采用质量差法计算O的含量。傅里叶变换红外光谱分析(FTIR,IRAffinity–1S)的检测波数范围为4000~500 cm–1,波数精度为0.01 cm–1,分辨率为0.09 cm–1,线性度小于0.07 %。总酸性官能团和羧基的含量通过氢氧化钡和醋酸钙滴定法[23-24]分析,设酚羟基的含量为总酸性基含量与羧基含量之差。参照缪刚芬[25]的方法,针对吸附前后的胡敏酸溶液,稀释后,分别测定250、365、465、665 nm波长处的吸光度E2、E3、E4、E6,按照式(1)进行计算芬香度DA[26]。
| ${\rm{DA}} = 52.509 - 6.78({{E}}2/{{E}}3)$ | (1) |
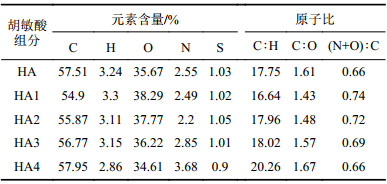
不同分子量HA的元素分析结果见表1。C、H、O、N、S各元素的含量范围分别在54.90%~57.95%、2.86%~3.30%、34.61%~38.29%、2.20%~3.69%、0.90%~1.05%之间;随着分子量组分量的增加,C元素的含量在逐渐增加,而H和O元素含量在逐渐减少,N和S元素没有规律的变化趋势,这与Bai[15]、张水勤[26]等的研究结果一致。胡敏酸各元素的原子比对评价HA的芳香度、含氧官能团的量和极性等具有很好的参考意义[26]。通常C/H的值越小其芳香度越低,饱和度越高,反之,则说明芳香度越高[27];C/O比例可以反映含氧官能团的含量,其值越大,含氧官能团越少;(N+O)/C的值通常用作胡敏酸的性判别指标,比值越小,表示HA的极性越小[28]。经过表征分析可知,HA及各分级分子量组分的C/H、C/O、(N+O)/C的原子比范围分别为16.64~20.26、1.43~1.67、0.66~0.74,原子比逐渐减少,说明随着分子量的增加,胡敏酸的芳香度越大,饱和度越低,含氧官能团越少,极性越弱,其疏水性越强。
| 表1 不同分子量胡敏酸的元素组成及相应原子比 Tab. 1 Elemental composition and atomic ratios of HA with different molecular weights |
 |
2.1.2 不同分子量胡敏酸的傅里叶变换红外光谱特征
不同分子量胡敏酸的FTIR光谱见图1。图1显示:各分子量胡敏酸之间的吸收谱带没有明显的变化,说明分级后的胡敏酸官能团种类没有变化。但其吸收峰强存在一定的差异,随着分子量组分的增大,3407、1708、1242 cm–1处的峰强逐渐减弱,表明在该峰位置处归属的羟基和羧基含量在减少;而1388 cm–1处的峰随分子量增大呈逐渐增强的趋势,1388 cm–1波数的峰归属于酚羟基中O—H变形振动峰,或者是甲基、亚甲基中的C—H变形振动峰,以及COO—不对称伸缩振动峰。总体来说,随着胡敏酸分子量的增大,其所含的羧基和羟基量均减少,而甲基、酚羟基在增加。
 |
| 图1 不同分子量胡敏酸的傅里叶变换红外图谱 Fig. 1 FTIR spectra of humic acid with different molecular components |
2.1.3 不同分子量胡敏酸的酸性官能团特征
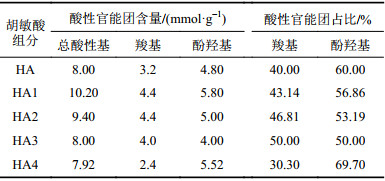
胡敏酸的酸性官能团含量及占比见表2。总酸性基含量在7.92~10.20 mmol/g之间,羧基的含量为2.4~4.4 mmol/g,酚羟基的含量为4.0~5.8 mmol/g,酚羟基的占比较羧基大,各组分的酚羟基占比均在50%及以上,表明胡敏酸的酸性更多地来源于酚羟基。对于不同分子量HA,总酸性基含量HA1 > HA2 > HA3 > HA4,羧基含量HA1= HA2 > HA3 > HA4,酚羟基含量HA1 > HA4 > HA2 > HA3,总体上呈现随分子量增加,酸性官能团含量减少的趋势,这与各组分的FTIR分析结果是一致的。
| 表2 胡敏酸的酸性官能团含量及占比 Tab. 2 Content and proportion of acid functional groups of humic acid |
 |
2.1.4 不同分子量胡敏酸的pH值
HA、HA1、HA2、HA3、HA4的pH值分别为4.29、3.33、3.52、3.59、3.61。胡敏酸和各分级组分的pH值范围为3.19~4.29,并随分子量的增加逐渐增加。有研究得出羧基的解离常数为3~4,酚羟基的解离常数为8~10[29],因此,含有更多羧基官能团的小分子量组分HA会电离释放更多的H+,导致其pH值较小。
2.1.5 胡敏酸中各分子量组分的质量分布通过对20 g胡敏酸进行分级提取后,获得了HA1:1.97 g,9.85%;HA2:3.75 g,18.75%;HA3:1.53 g,7.65%;HA4:10.34 g,51.7%。胡敏酸的分子量大部分大于100 kDa,占到了51.7%;其次18.75%的胡敏酸分子量组分处于10~50 kDa之间;小于10 kDa和大于50~100 kDa的分子量组分较少,分别占9.8%和7.65%。提取过程中,存在质量损失(2.41 g,12.5%),原因可能是:部分胡敏酸会残留在超滤膜上;对分级后的各组分进行酸沉淀时有部分小分子胡敏酸由于强亲水性而未被完全沉淀。
2.1.6 不同分子量胡敏酸的紫外–可见光光谱特征表3为不同分子量胡敏酸的紫外–可见光谱特征。E4/E6值越低;极性越低且腐殖化程度越高[30]。由表3可知,不同分子量胡敏酸的E4/E6值存在显著的区别,随分子量的增加,E4/E6值大幅减小,说明其芳香度和腐殖化程度随分子量增加而增高,极性降低[15]。不同分子量胡敏酸的E2/E3值的变化与E4/E6相同,即随着分子量的增大,其芳香度越大。
| 表3 不同分子量胡敏酸的紫外–可见光光谱特征 Tab. 3 UV–visible spectra of different molecular humic acid |
 |
2.2 不同分子量胡敏酸作用下蒙脱石体系对镉的吸附行为研究 2.2.1 不同分子量胡敏酸–蒙脱石复合体系对镉的等温吸附分析
图2为不同分子量胡敏酸作用下蒙脱石–胡敏酸体系对镉的吸附量。由图2可以看出:在同一分子量胡敏酸作用下,镉的吸附量均随初始浓度增加而增加;对于不同分子量的胡敏酸,其分子量越大,镉吸附量增加的幅度也越大。在同一镉初始浓度时,对镉的吸附量影响呈现HA4> HA3 >HA2 >HA1。当镉的初始浓度为50 mg/L时,HA、HA1、HA2、HA3、HA4与蒙脱石的复合体系对镉的吸附量分别为1.99、2.11、2.46、4.12、4.88 mg/g。
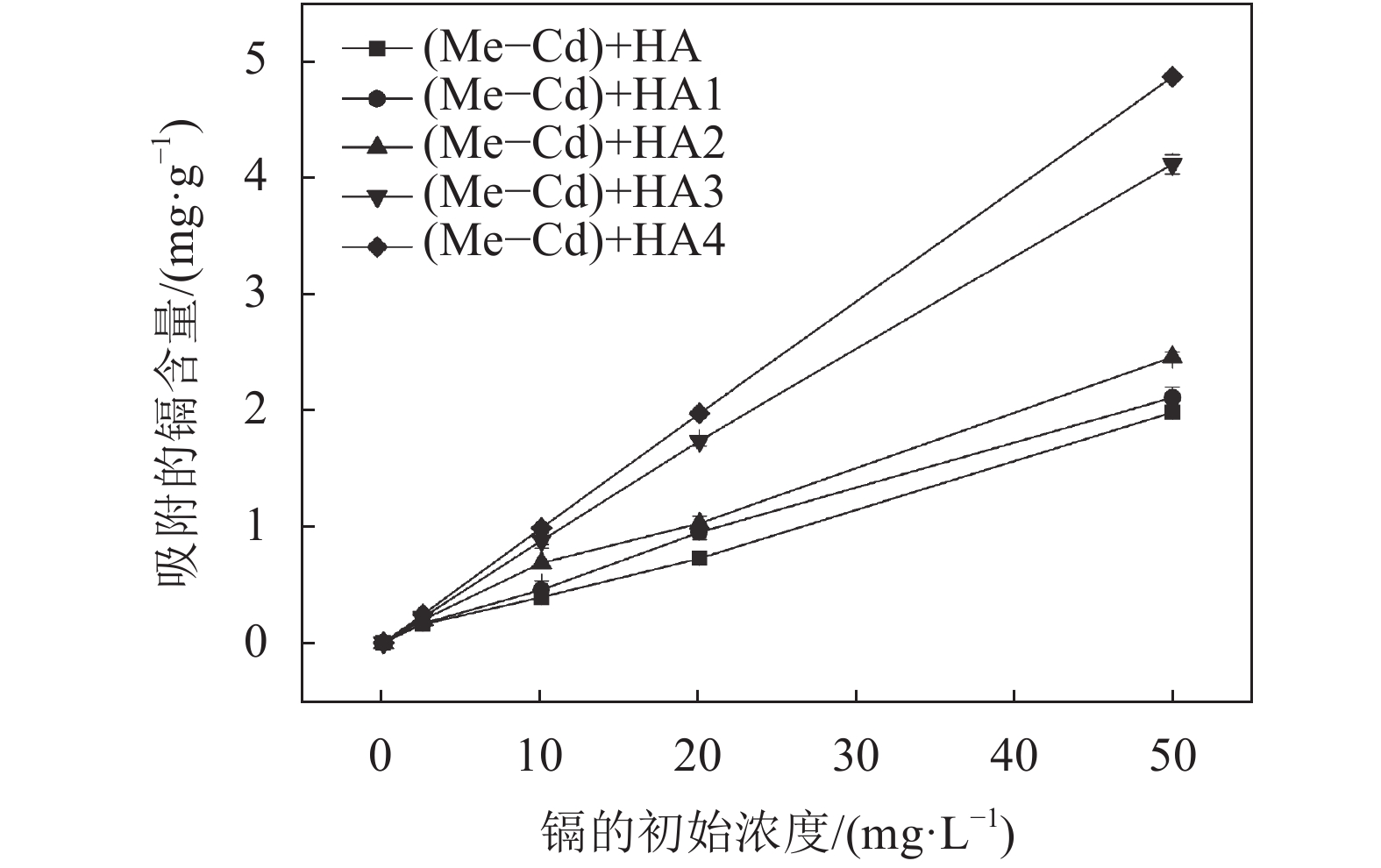 |
| 图2 不同分子量胡敏酸作用下蒙脱石对镉的吸附 Fig. 2 Adsorption of Cd by Me with HA of different molecular weights |
通过Langmuir模型对不同分子量胡敏酸作用下蒙脱石–胡敏酸体系吸附镉的量qm进行了等温吸附曲线拟合,拟合的参数结果列于表4,其拟合的相关系数都在0.94以上,表明不同分子量的胡敏酸对镉的吸附可能均属单分子层于吸附。
| 表4 不同分子量HA作用下蒙脱石对镉吸附的Langmuir拟合结果 Tab. 4 Langmuir fitting results of Cd adsorption by Me under different molecular weights |
 |
不同分子量胡敏酸作用下体系对胡敏酸的吸附量如图3所示,在同一初始镉浓度下,胡敏酸在蒙脱石上的吸附量均呈现HA4 >HA3 >HA2 >HA1。
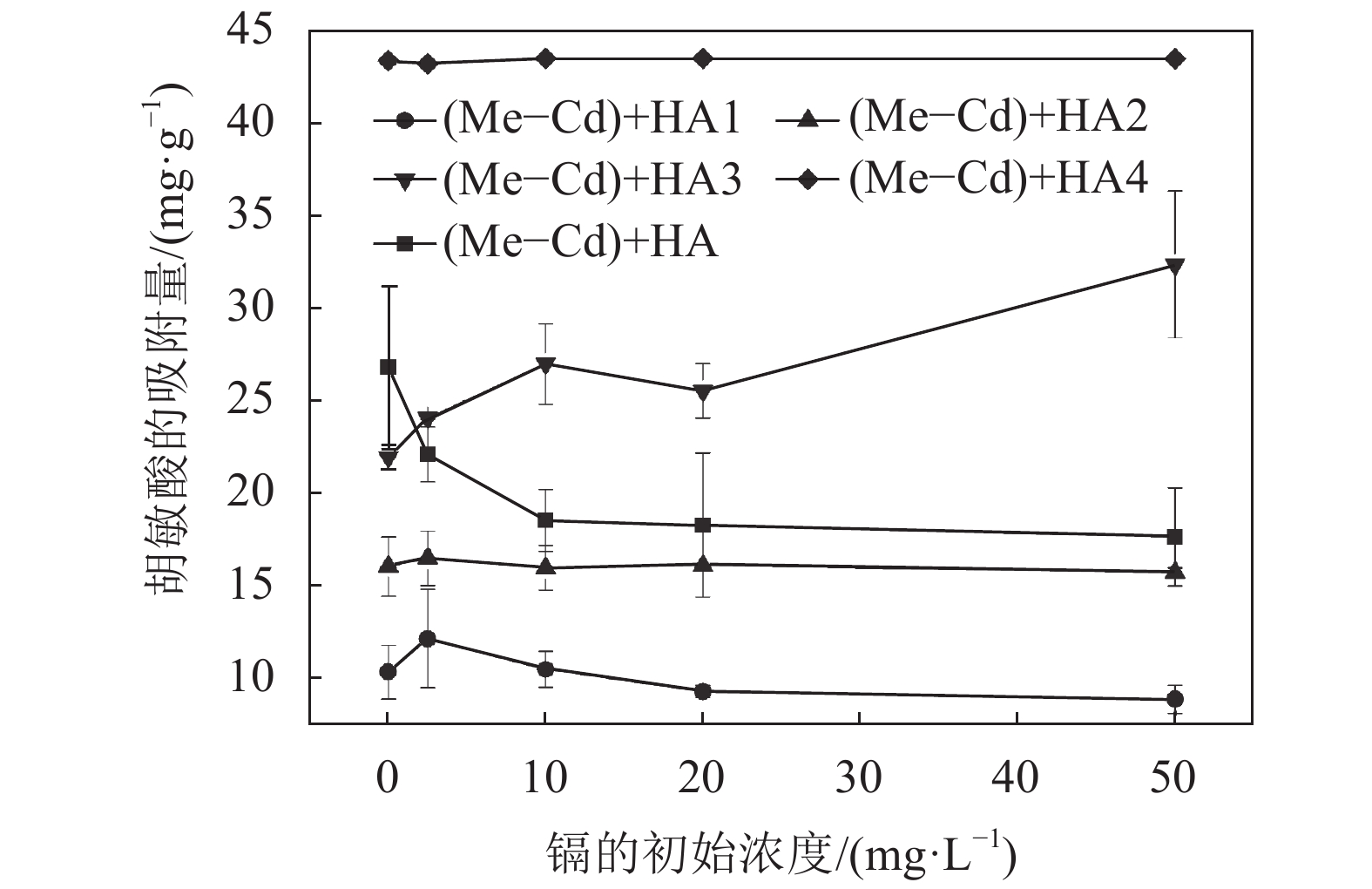 |
| 图3 不同分子量胡敏酸作用下蒙脱石对胡敏酸的吸附量 Fig. 3 Adsorption of HA by Me with HA of different molecular weights |
由图3还可知:对于同一胡敏酸分子量组分,HA1负载后体系对镉的吸附量随镉的初始浓度的增加总体上呈现减少的趋势;HA2的吸附量变化不明显,随镉的初始浓度增加有微弱降低的趋势;HA3的吸附量随隔的初始浓度的增加逐渐增加;HA4基本上已经被完全吸附在蒙脱石上,并且随镉的浓度的增加没有发生明显的变化,其原因可能是这种大分子胡敏酸因为疏水作用与蒙脱石结合时覆盖在蒙脱石表面,且与已经吸附在蒙脱石表面的镉不产生竞争作用。
不同分子量胡敏酸作用后溶液中的pH值如图4所示。由图4可知:所有的pH值均大于7.0。吸附后的溶液pH值随着镉的初始浓度的增加而降低;同一镉初始浓度下的不同分子量HA作用后pH值大小为HA2 > HA1 > HA3 > HA4。吸附后的pH值变化与镉吸附量具有很高的相关性,镉吸附得越多,就有越多的酸性官能团解离出H +,溶液中的pH值越低。
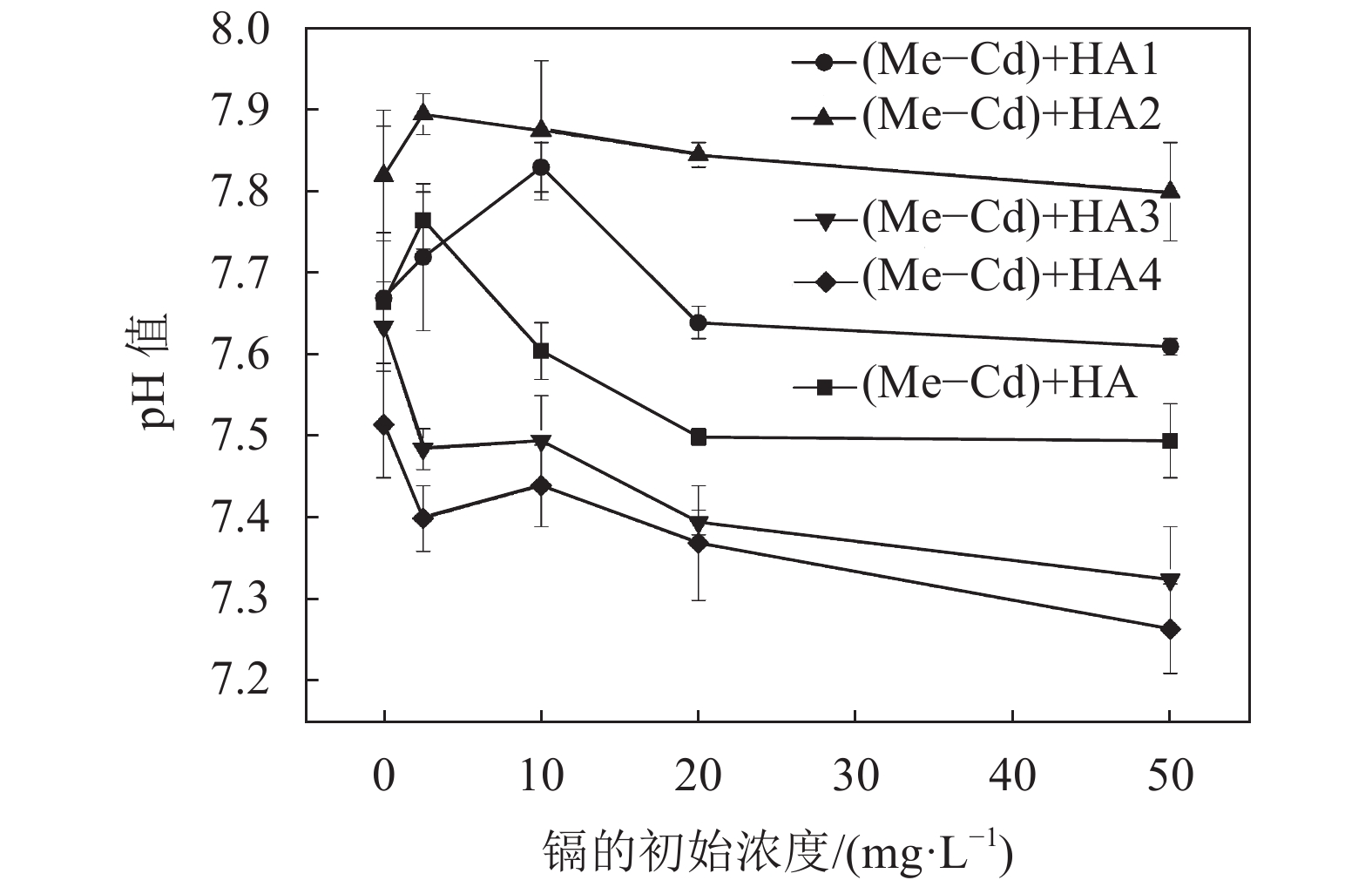 |
| 图4 不同分子量胡敏酸作用后溶液中的pH值 Fig. 4 pH of the solution under the action of different molecular weights HA |
2.2.2 不同分子量胡敏酸–蒙脱石复合体系吸附镉的稳定性分析
镉的初始浓度为50 mg/L时,不同分子量胡敏酸作用下蒙脱石吸附的镉的各形态占比见图5。由图5可知:各分子量组分胡敏酸作用下的镉形态占比没有显著的差异,均呈现可还原态 > 弱酸可溶态 > 可氧化态 > 残渣态的趋势,复合体系吸附的镉稳定性较好,表明环境条件改变时,对镉可能保持较好的吸附效果。
 |
| 图5 不同分子量胡敏酸作用下蒙脱石–胡敏酸体系吸附的镉的稳定性 Fig. 5 Stability of Cd adsorbed by Me and HA with different molecular weights |
2.3 不同分子量胡敏酸作用下蒙脱石对镉的吸附机制研究 2.3.1 不同分子量胡敏酸作用下吸附镉前后蒙脱石表面官能团变化
图6为蒙脱石吸附不同分子量胡敏酸后的FTIR图谱。由图6可知:3618 cm–1(羟基)处的峰强在HA3和HA4作用下有减弱,说明大分子胡敏酸可能与蒙脱石表面羟基作用;3444 cm–1(层间水羟基)处的峰强加入胡敏酸后有所降低,推断是由于Cd2+的离子键桥作用,胡敏酸可能会与蒙脱石的层间水间接发生作用,并且分子量越小作用越强[10];1385 cm–1(甲基等)处的峰在加入不同分子量胡敏酸后均有不同程度的增强,胡敏酸分子量越大,含有的甲基更多,表明1385 cm–1处峰的增强极有可能来源于胡敏酸分子量的增加[31]。总体来说,FTIR分析显示胡敏酸分子量越小越易间接与蒙脱石层间水发生作用,分子量越大越容易与蒙脱石表面羟基作用。
 |
| 图6 蒙脱石吸附不同分子量HA前后的FTIR图谱 Fig. 6 FTIR of montmorillonite before and after adsorption of different molecular weights HA |
2.3.2 不同分子量胡敏酸作用下复合体系对镉吸附量及吸附稳定性的变化机制
在三元体系中,随着加入的胡敏酸分子量的增大,蒙脱石吸附的镉和胡敏酸均越多。小分子量胡敏酸表面的含有更多的羧基、羟基等酸性官能团,会与蒙脱石表面暴露的硅醇基和铝醇基竞争吸附镉,并且,由于其较强的亲水性,会将竞争吸附的镉带入溶液中,使蒙脱石吸附的镉含量减少。大分子量胡敏酸表面羧基和羟基等含氧官能团较小分子量的少,同时,疏水基团—CH3[32]含量较小分子量分的多。疏水作用下,水分子会倾向于把分子量较大的胡敏酸往蒙脱石上挤压,使胡敏酸和蒙脱石更易结合[28];另一方面,大分子量胡敏酸有更高的芳香度,蒙脱石对大分子胡敏酸也有更高的亲和力[16],因此,胡敏酸分子量越大,越容易被蒙脱石吸附,与此同时其所吸附的镉会间接吸附到蒙脱石上,从而增加镉的吸附量。而Cd2+作为离子键桥连接的可能是胡敏酸上的酚羟基与蒙脱石上的硅醇基或铝醇基。
小分子胡敏酸HA1含有的酸性官能团最多,其吸附的镉稳定性更强[15],但是其吸附的镉多数残留在溶液中,因此使镉的各形态含量都较少;HA1吸附镉会进入蒙脱石层间与层间水结合,这部分被吸附的镉稳定性较强;此外,镉还会连接HA1和蒙脱石表面的硅醇基和铝醇基(Me–Cd–HA),所以,HA1作用下的稳定形态占比较高。HA2作用下吸附的镉的各形态含量较HA1有所增加,但其稳定形态占比却小于HA1作用下,这是因为HA2表面的酸性官能团减少,亲水性降低,吸附的镉的稳定性也较HA1弱;同时,随着分子量的增大,进入蒙脱石层间的胡敏酸减少,减少了部分稳定吸附的镉含量。HA3作用下可还原态和可氧化态镉增幅显著。究其原因:一方面是减少了竞争吸附蒙脱石负载的镉的含量;另一方面是疏水作用会使HA3–Cd吸附到蒙脱石表面,使得镉稳定吸附占比最大。HA4具有强疏水作用,体系中的镉会大量以HA4–Cd的形式吸附到蒙脱石表面,同时基本不会影响到蒙脱石已经吸附的镉,所以使HA4各形态的吸附量都很大;但由于其表面的含氧官能较少,一部分镉直接吸附到蒙脱石上,这部分吸附的镉不稳定,因此,弱酸可溶态镉含量较高,稳定吸附的镉占比最小。
3 结 论随着分子量的增加,胡敏酸的饱和度降低,含氧官能团减少,极性减弱,疏水性变强。在蒙脱石–镉–胡敏酸复合体系中,随着胡敏酸分子量的增大,蒙脱石吸附的镉及胡敏酸含量均随着分子量的增大而增加,且吸附的镉大多为较稳定的还原态镉。其作用机制是小分子胡敏酸进入蒙脱石–镉体系后,会竞争吸附蒙脱石上负载的镉,再通过较强的亲水性将镉带入溶液中;大分子胡敏酸很难进入蒙脱石层间,由于较强的疏水性会覆盖在蒙脱石表面,对蒙脱石吸附的镉进行包裹。综合吸附量和吸附稳定性的共同影响可知:胡敏酸分子量越大,体系吸附的稳定态镉含量最高;当胡敏酸分子量大于100 kDa时,蒙脱石–胡敏酸体系对镉有较好的稳定吸附效果。该结论对胡敏酸与黏土矿物作为钝化材料应用于镉污染农田土壤修复具有指导意义。
| [1] |
Wang Lili.The remediation of heavy metal contaminated soil around a Pb/Zn mine by different biochars derived from rice straw and pig manure[D].Hangzhou:Zhejiang University,2015. 王丽丽.不同生物碳对铅锌矿尾矿重金属污染土壤修复效果的研究[D].杭州:浙江大学,2015. |
| [2] |
Xu Yi,Liang Xufeng,Xu Yingming,et al. Remediation of heavy metal-polluted agricultural soils using clay minerals:A review[J]. Pedosphere, 2017, 27(2): 193-204. DOI:10.1016/S1002-0160(17)60310-2 |
| [3] |
Li Ming.Study on adjustment of planting pattern of vegetable soils contaminated by cadmium in acid zone[D].Nanjing:Nanjing Agricultural University,2018. 李明.酸性镉污染蔬菜产地种植结构调整技术探讨[D].南京:南京农业大学,2018. |
| [4] |
Huang Shunsheng,Hua Ming,Jin Yang,et al. Investigation of cadmium pollution and its major sources in vegetable land in the suburb of Nanjing city[J]. Chinese Journal of Soil Science, 2008, 39(1): 129-132. [黄顺生,华明,金洋,等. 南京郊区某菜地土壤镉污染水平及其来源调查[J]. 土壤通报, 2008, 39(1): 129-132. DOI:10.3321/j.issn:0564-3945.2008.01.025] |
| [5] |
Wu Xiaoxiao,Cao Rongbin,Mi Changhong,et al. Research progress of in-situ passivated remedial materials for heavy metal contaminated soil[J]. Journal of Agricultural Resources and Environment, 2019, 36(3): 253-263. [吴霄霄,曹榕彬,米长虹,等. 重金属污染农田原位钝化修复材料研究进展[J]. 农业资源与环境学报, 2019, 36(3): 253-263. DOI:10.13254/j.jare.2018.010] |
| [6] |
Blondeau R. Separation of low molecular weight humic acids with Sephadex G25[J]. Plant and Soil, 1985, 87(3): 441-444. DOI:10.1007/BF02181912 |
| [7] |
Francioso O,Sanchez–Cortes S,Casarini D,et al. Spectroscopic study of humic acids fractionated by means of tangential ultrafiltration[J]. Journal of Molecular Structure, 2002, 609(1/2/3): 137-147. DOI:10.1016/S0022-2860(01)00971-1 |
| [8] |
Christl I,Knicker H,Kögel–Knabner I,et al. Chemical heterogeneity of humic substances:Characterization of size fractions obtained by hollow-fibre ultrafiltration[J]. European Journal of Soil Science, 2010, 51(4): 617-625. DOI:10.1111/j.1365-2389.2000.00352.x |
| [9] |
Liu A G,Gonzalez R D. Adsorption-desorption in a system consisting of humic acid,heavy metals,and clay minerals[J]. Journal of Colloid and Interface Science, 1999, 218(1): 225-232. DOI:10.1006/jcis.1999.6419 |
| [10] |
He Weihong.Adsorption of heavy metal on clay mineral-humic acid complexes[D].Nanjing:Nanjing Agricultural University,2007. 何为红.重金属离子在黏土矿物–胡敏酸复合体上的吸附研究[D].南京:南京农业大学,2007. |
| [11] |
Zhang Lichao,Bao Xianming,Yu Fubo,et al. Studies on the adsorption mechanisms of fulvic acid and humic acid on smectite[J]. Research of Environmental Sciences, 2013, 26(12): 1333-1339. [张立超,包先明,余福波,等. 富里酸和胡敏酸在蒙脱石上的吸附特性[J]. 环境科学研究, 2013, 26(12): 1333-1339. DOI:10.13198/j.issn.1001-6929.2013.12.01] |
| [12] |
Zhang Xin,Zhao Lanpo,Zhao Xingmin,et al. Effects of straw and aluminum sulfate on the adsorption of humic acids on soda saline-alkali soil[J]. Journal of Soil and Water Conservation, 2019, 33(4): 308-314. [张鑫,赵兰坡,赵兴敏,等. 秸秆和硫酸铝改良剂对苏打盐碱土吸附腐殖酸性能的影响[J]. 水土保持学报, 2019, 33(4): 308-314. DOI:10.13870/j.cnki.stbcxb.2019.04.04] |
| [13] |
Tan K H. Variation in soil humic compounds as related to regional and analytical differences[J]. Soil Science, 1978, 125(6): 351-358. DOI:10.1097/0001064-197806000-00003 |
| [14] |
Ni L,Su L,Wang P,et al. The characterization of dissolved organic matter extracted from different sources and their influence on cadmium uptake by microcystis aeruginosa[J]. Environmental Toxicollgy Chemistry, 2017, 36(7): 1856-1863. DOI:10.1002/etc.3728.Epub2017Feb23 |
| [15] |
Bai Hongcheng,Jiang Zhenmao,He Minjin,et al. Relating Cd2+ binding by humic acids to molecular weight:A modeling and spectroscopic study
[J]. Journal of Environmental Sciences, 2017, 70(28): 154-165. DOI:10.1016/j.jes.2017.11.028 |
| [16] |
Kozyatnyk I,Bounchet S,Bjorn E,at el. Fractionation and size-distribution of metal and metalloid contaminants in a polluted groundwater rich in dissolved organic matter[J]. Journal of Hazardous Materials, 2016, 318: 194-202. DOI:10.1016/j.jhazmat.2016.07.024 |
| [17] |
Ye Biying,Bai Hongcheng,Liu Gaoyun,et al. Effects of different molecular weight fractions of natural organic matter on the adsorption and desorption of cadmium in purple soil[J]. Journal of Agro–Environment Science, 2019, 38(8): 1963-1972. [叶碧莹,柏宏成,刘高云,等. 天然有机质不同分子量组分对紫色土镉吸附–解吸的影响[J]. 农业环境科学学报, 2019, 38(8): 1963-1972. DOI:10.11654/jaes.2018-157] |
| [18] |
Zhang Xueping.Adsorption of some heavy metal ions from aqueous solution by modified bentonite[D].Xiangtan:Xiangtan Universtiy,2014. 张雪萍.膨润土的改性及其对部分重金属离子的吸附研究[D].湘潭:湘潭大学,2014. |
| [19] |
Wang Haojie.Study on the synthesis of five clay mineral colloids and their adsorption characteristics of Cd2+,Pb2+,Zn2+[D].Shenyang:Northeastern university,2012. 王浩杰.五种土壤矿物胶体的合成及其对镉、铅、锌吸附特征的研究[D].沈阳:东北大学,2012. |
| [20] |
Walkley A,Black A. Methods of soil analysis[J]. American Potato Journal, 1965, 42(11): 345-346. DOI:10.1007/BF02869702 |
| [21] |
Ma Liangang,Xiao Baohua. Review on extraction and fractionation of humic substance from soils[J]. Bulletin of Mineralogy,Petrology and Geochemistry, 2011, 30(4): 465-471. [马连刚,肖保华. 土壤腐殖质提取和分组综述[J]. 矿物岩石地球化学通报, 2011, 30(4): 465-471. DOI:10.3969/j.issn.1007-2802.2011.04.01] |
| [22] |
Umoren I U,Udoh A P,Udousoro I I. Concentration and chemical speciation for the determination of Cu,Zn,Ni,Pb and Cd from refuse dump soils using the optimized BCR sequential extraction procedure[J]. The Environmentalist, 2007, 27(2): 241-252. DOI:10.1007/s10669-007-9001-3 |
| [23] |
Schnitzer M.Chemical,spectroscopic,and thermal methods for the classification and characterization of humic substances[C]//Proceedings of International Meeting Humic Substances.Toyo:IMHS,1972.
|
| [24] |
黄瀛华.煤化学及工艺学实验[M].上海:华东化工学院出版社,1988.
|
| [25] |
Miao Gangfen.Sorption mechanisms of Cu2+ by sequentially extracted humic acids from a sediment[D].Hangzhou:Zhejiang University,2015. 缪刚芬.沉积物中逐级提取胡敏酸对Cu2+的吸附机理[D].杭州:浙江大学,2015. |
| [26] |
Zhang Shuiqin.Structural characteristics of different humic acid fractions and their regulation on urea[D].Beijing:China Agricultural University,2018. 张水勤.不同腐植酸级分的结构特征及其对尿素的调控[D].北京:中国农业大学,2018. |
| [27] |
Hao Xiangxiang,Dou Sen,Han Xiaozeng,et al. Structure of humic acid in soil aggreates under different ecosystems in typical black soil region of Northeast China[J]. Acta pedologica sinica, 2014, 51(4): 824-833. [郝翔翔,窦森,韩晓增,等. 典型黑土区不同生态系统下土壤团聚体中胡敏酸的结构特征[J]. 土壤学报, 2014, 51(4): 824-833. DOI:10.11766/trxb20130908040] |
| [28] |
Tian Jihong.Adsorption of humic acid from Zhaotong lignite on clay minerals/soil[D].Kunming:Kunming University of Science and Technology,2018. 田吉宏.昭通褐煤腐植酸在黏土矿物/土壤上的吸附研究[D].昆明:昆明理工大学,2018. |
| [29] |
Liu A,Gonzalez R D. Modeling adsorption of copper(Ⅱ),cadmium(Ⅱ) and lead(Ⅱ) on purified humic acid[J]. Langmuir, 2000, 16(8): 3902-3909. DOI:10.1021/la990607x |
| [30] |
En He.Binding characteristics of heavy metals to natural humic aicd fractions sequentially extracted from the lake sediment[D].Hohhot:Inner Mongolia University,2016. 恩和.湖泊沉积物中不同级分胡敏酸对重金属吸附特征研究[D].呼和浩特:内蒙古大学,2016. |
| [31] |
Liao Pingfan,Wu Pingxiao,Wu Weimin,et al. Study of the sorption of humic acids on the clays[J]. Bulletin of Mineralogy,Petrology and Geochemistry, 2009, 28(3): 272-277. [廖平凡,吴平霄,吴伟民,等. 粘土矿物对胡敏酸的吸附行为研究[J]. 矿物岩石地球化学通报, 2009, 28(3): 272-277. DOI:10.3969/j.issn.1007-2802.2009.03.01] |
| [32] |
Li Meng,Wu Si,Zhang Bin. Hydrophilicity and hydrophobicity of adsorption of NOM on solid-liquid interface[J]. Environmental Science & Technology, 2012, 35(3): 38-42. [李孟,吴思,张斌. 固液界面NOM吸附中疏水效应的影响研究[J]. 环境科学与技术, 2012, 35(3): 38-42. DOI:10.3969/j.issn.1003-6504.2012.03.00] |
 2021, Vol. 53
2021, Vol. 53


