Principles and Progress of Advanced Hydrogen Production Technologies in the Context of Carbon Neutrality
-
摘要: 在全球大力倡导“碳中和”的背景下,发展高能效、低成本、零排放的先进可再生能源电解制氢技术将成为实现“碳中和”的关键。然而,当前化石能源制氢技术仍处于主流地位,具有成本低的优势,但存在固有的碳排放,而利用可再生能源电解水制氢则被认为是未来氢能的技术路线,近年来,主流的碱性电解制氢技术发展迅速,有望在可再生能源价格持续下降的趋势下,大幅降低其制氢成本。本文将对化石制氢和电解水制氢技术的发展背景、技术现状和前沿发展方向等进行总结、思考及探讨。针对化石燃料制氢,阐述天然气重整制氢与煤气化制氢的发展路径,评价新型化学链制氢技术在降低化石制氢碳排放上的潜力;针对电解水制氢技术,系统评估4种主流电解水路线,即碱性电解水制氢、阴离子交换膜电解制氢、质子交换膜电解制氢以及固体氧化物基电解制氢的技术特点,并对碱性电解水高温高压热力学优化、KOH高温固化以及固态复合电解质开发等电解水技术新发展做出详细的评述。在此基础上,分析未来氢能应用场景的发展方向,认为海水制氢是未来大规模氢能系统的核心,深入分析海水制氢所面临的析氯腐蚀挑战、热力学机理、低氯选择性析氧催化剂开发等关键原理与技术,并提出相关发展建议,以期促进氢能技术发展。Abstract: In the context of global “carbon neutrality”, the development of advanced renewable hydrogen production technology with high energy efficiency, low cost and zero emission will become the key to achieving “carbon neutrality”. However, hydrogen production from fossil energy is still dominating the market, with low cost, but inherent carbon emissions. Hydrogen production from electrolytic water using renewable energy is considered to be the core of the renewable energy grid in the future with the continuous decline of renewable energy prices. This paper summarized the background, technical status and cutting-edge development of hydrogen production technologies. Regarding fossil fuels reforming, technological evaluation of natural gas reforming and coal gasification is conducted. The potential of chemical loping technology in effectively reducing the carbon emissions of reforming was evaluated. Regarding the water splitting, the technical characteristics and recent progresses of four mainstream water splitting routes, i.e. alkaline electrolysis, anion exchange membrane electrolysis, proton exchange membrane electrolysis, and solid oxide-based electrolysis technologies were compared. On this basis, the prospect of hydrogen production from water splitting (especially from seawater) was discussed for the large-scale hydrogen energy system in the future, by evaluating the existing challenges/opportunities in seawater splitting, including the chlorine evolution, thermodynamic optimization, and catalyst development. Finally, relevant suggestions were put forward in order to promote the research of hydrogen production technologies.
-
在全球“碳中和”的发展背景下,世界各国均在大力发展氢能技术,例如欧盟推出“欧洲燃料电池和氢能联合计划”;美国能源部制定“氢能源计划”,推动美国向“以氢能源为基础的能源体系转变”;日本能源白皮书明确将“实现氢能源社会” 列入未来发展目标,计划到2030年全面建立氢能发电和氢能供应体系。中国2030年“碳中和”、2060年“碳达峰”目标的提出将驱动中国未来整个能源体系、经济体系以及科技创新的转型,同时将极大的推动中国氢能发展,特别是在化石能源转型、电网能源存储、交通运输、钢铁生产和化工生产、建筑暖通等亟待碳减排的领域[1]。
自2019年始,氢能技术与氢能产业发展迅速。预估到2050年,全球氢能可再生能源能力达到将近10亿kW,占总装机量的17.7%(表1)[2],同时全球氢能市值将达到10万亿欧元。
但到目前为止,氢能尚未真正成为全球基础能源。据统计,即便是在氢能发展快速的欧洲,氢能在能源体系中的占比目前也仅为2%(图1)[2],尚需制氢–储氢–用氢整个产业链条上的进一步技术突破和推广应用。尤其是在上游制氢环节,目前全球超过 95% 的氢气制取来源于化石燃料重整[3],整个氢能产业高度依赖于化石燃料,并产生大量的二氧化碳,例如,传统煤制氢每千克氢气的二氧化碳排放平均强度高达22.65 kg(未结合碳捕集),天然气制氢每千克氢气也产生相当数量的二氧化碳排放(8~16 kg)[4]。
可再生能源制氢具有低排放的优势,但却受制于成本。据统计,基于大工业电价(0.61 元/(kW·h))的碱性水电解制氢成本约为3.69 元/m3(按电耗成本占总成本的80%测算)[5], 而煤炭制氢成本仅为0.34 元/m3,天然气制氢成本则在1.35 元/m3, 具有相当大的差距。只有当可再生能源每度电成本低于0.5元时,氢气成本(2.6 元/m3)与汽油热力成本相比才具有竞争性。而这一目标,在当前风电、光伏成本快速下降的趋势下,极有希望达到。以中国为例,在“十四五”时期,中国海上风电工程投资造价预计下降 20% 左右,每度电成本下降至 0.370~0.523 元/ (kW·h)[6]。因此,在未来“碳中和”以及相关可再生能源快速发展的两大趋势下,制氢技术预计将迎来成本和碳排放的双重下降,将有效推动整个氢能产业链的发展。
作为整个产业链的最上游,低成本、低能耗的清洁制氢技术仍有待发展。因此,本文将对制氢技术领域发展做简单的梳理总结,并着重就可再生能源电解制氢技术进行分析与展望,对中国氢能发展提供思路。
1. 化石制氢新技术
传统化石制氢技术,如天然气制氢、煤制氢、甲醇制氢等大规模化制氢仍是全球主要氢气来源,每年7000万t的氢产量中,约75%以天然气为原料,23%以煤炭为原料, 排放CO2约830亿t[7]。进一步降低化石燃料制氢的碳排放是其未来发展的首要挑战。其中,传统的天然气蒸汽重整制氢技术始于1926 年[8],通过顶烧蒸汽重整炉将天然气中的甲烷等碳氢成分催化生成氢气、一氧化碳和二氧化碳,反应如式(1)所示:
$$ {\text{C}}{{\text{H}}_4} + 0.5{{\text{H}}_{\text{2}}}{\text{O}} \to 0.5{\text{CO}} + 1.5{{\text{H}}_2},\Delta {{{H}}_{298}} = 103\;{\rm{kJ}}/{\rm{mol}} $$ (1) 式中,ΔH298为反应标准焓变。随后经过水汽变换反应提升氢气浓度(一氧化碳与水蒸气反应生成额外的氢气和二氧化碳),最后通过变压吸附装置提纯。
天然气蒸汽重整技术成熟,应用广泛,是工业上最常用的制氢方法,目前可每小时覆盖氢气10 000~20 000 m3。但天然气蒸汽重整制氢过程在热力学上为强吸热(ΔH298=103 kJ/mol),重整反应器内温度难以均衡,常引发催化剂失效;反应需要外界补充大量的热,使制氢能耗升高,燃料成本占总生产成本的 52%~68%。为解决上述问题,近年来发展出了自热重整以及部分氧化重整技术,用以缓解重整制氢过程中的热平衡问题。
自热重整采用在传统蒸汽甲烷重整反应体系中引入氧气与甲烷的氧化放热反应,降低单位氢气吸热强度,实现热量的平衡与富氢合成气产品的制取,反应如式(2)所示:
$$ {\text{C}}{{\text{H}}_4} + 0.25{{\text{O}}_{\text{2}}}{\text{ + 0}}{\text{.5}}{{\text{H}}_{\text{2}}}{\text{O}} \to {\text{CO}} + 2.5{{\text{H}}_2},\Delta {{{H}}_{298}} = 53\;{\rm{kJ/mol}} $$ (2) 与自热重整类似,甲烷部分氧化制氢也采用了引入氧气的方案[9],但不同点在于氧气完全替代了重整剂水,反应如式(3)所示:
$$ {\text{C}}{{\text{H}}_4} + 0.5{{\text{O}}_{\text{2}}} \to {\text{C}}{{\text{O}}_{\text{2}}} + {{\text{H}}_2},\Delta {{{H}}_{298}} = - 35.71\;{\rm{kJ}}/{\rm{mol}} $$ (3) 该反应放热较为温和,同样可减缓热不均匀性,但缺点在于CO2 的产生排放需要进一步的碳捕集和利用。
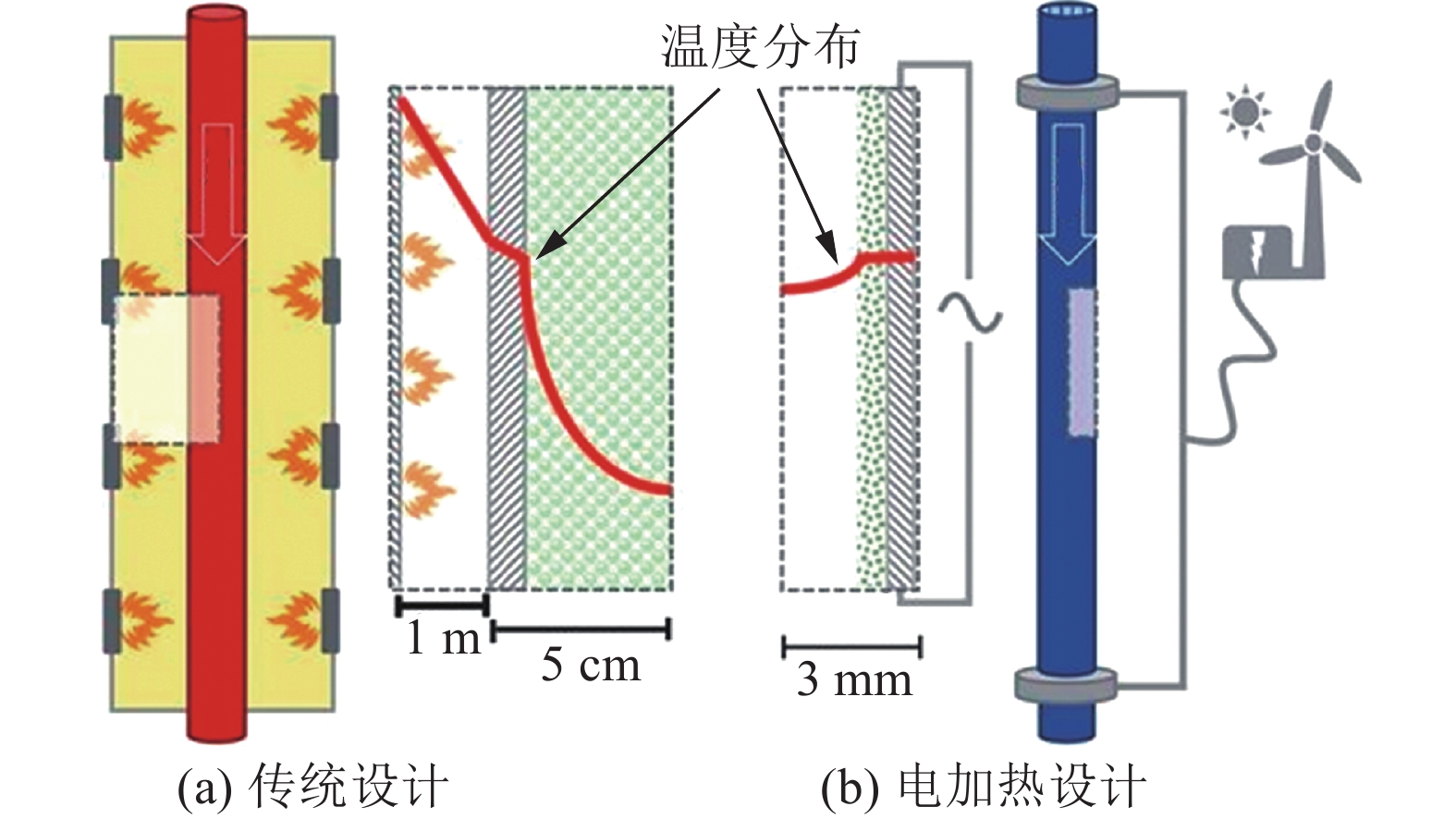
近年来,发展出了将电加热与甲烷蒸汽重整(steam methane reforming,SMR)反应器进行高度集约化耦合的思路,从而使反应器内部更加接近热平衡,提高催化剂利用率,提升整体供热效率。Wismann等[10]根据这一思路提出了一种反应器集成设计方案(图2),比现有甲烷重整设备体积小100倍,同时将催化剂利用率从20%提高到65%。Wismann等[10]认为,如果该方案在全球范围内应用,将能减少近1%的二氧化碳排放量。从全生命周期的碳排放的角度来讲,其用电来源的碳排放应重点考虑,特别是应该因地制宜的将天然气制氢工厂所在区域的可再生能源利用起来,例如,海上天然气开采现场制氢与海上风电相耦合,实现多能互补、风电调峰的同时,以电热方式实现了可再生能源的储存与天然气–风电协同制氢。例如,英国北海海域现存海上风电累装机量达到994.5万kW,同时已经拥有海上天然气平台200余个以及1.5万km长的天然气(或富氢天然气)管道[11]。上述技术若能大规模应用,可作为海上天然气制氢–风电制氢–风电并网的多能耦合互补利用的一种方式,提升风电综合能效,从而降低制氢的总体碳排放。
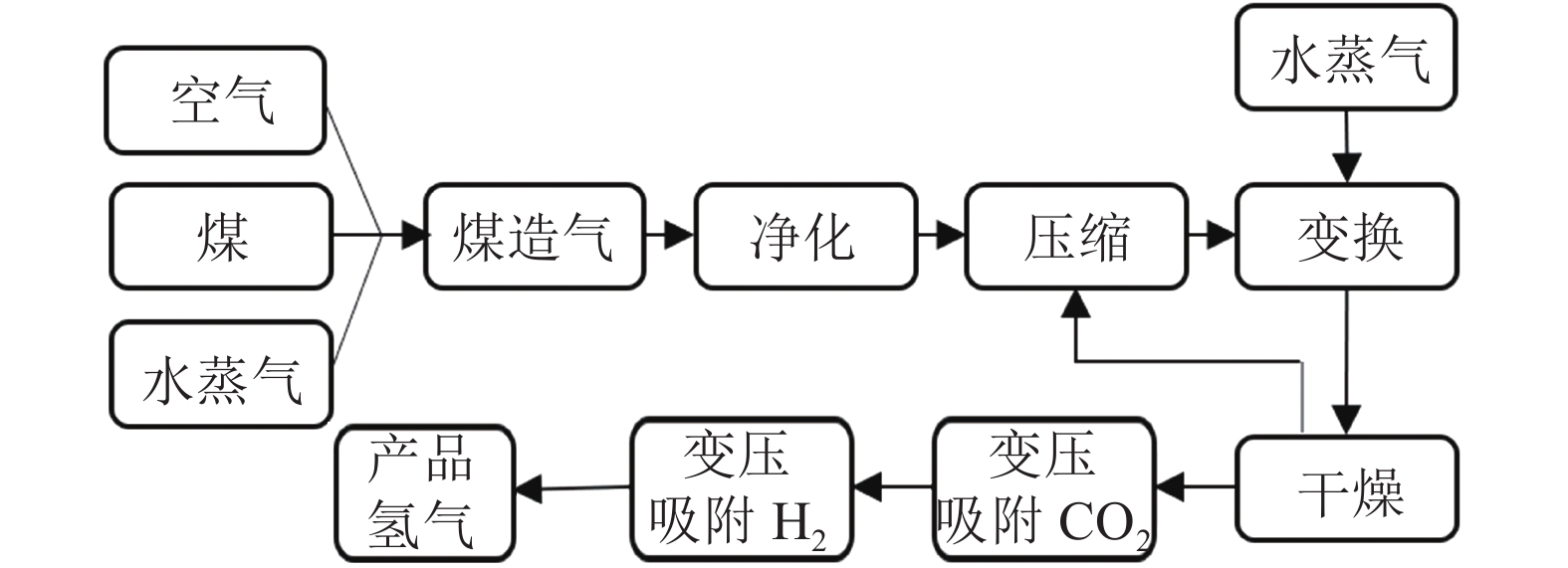
与天然气制氢相类似,煤气化制氢也是成熟的大规模化石制氢技术。其流程[12]如图3所示,煤气化制氢经过高温气化造气(H2+CO)、净化、CO 与水蒸气反应变换成 H2与CO2后,需要通过变压吸附等CO2捕集手段减少产品气中的CO2浓度。但遗憾的是,目前仍旧缺乏低成本的碳捕集技术,限制着化石制氢如煤气化等的低碳化发展。
近年来,获得最多关注的化石制氢新技术无疑是化学链重整直接制氢技术(chemical looping reforming)[13]。化学链重整利用固体氧离子载体的反复氧化还原,实现碳氢燃料的重整(或氧化)制氢。具有高效二氧化碳内分离和低有害氮氧化物生成等特点,是低排放,低污染、高效率的先进制氢手段。其基本原理是首先利用氧化态的氧离子载体在无空气条件下重整碳氢燃料,获得H2,随后将还原态固体氧离子载体与空气反应,再生成氧化态的氧离子载体。如此循环利用氧离子载体,从而实现间歇性的碳氢燃料重整。化学链的概念最早出现在20世纪初期的热化学制氢工艺领域,由 Messerschmitt[14]提出(蒸汽–铁工艺),主要利用氧化铁矿石作为氧离子载体,使炉煤气和水蒸气发生间歇性重整,制取氢气。
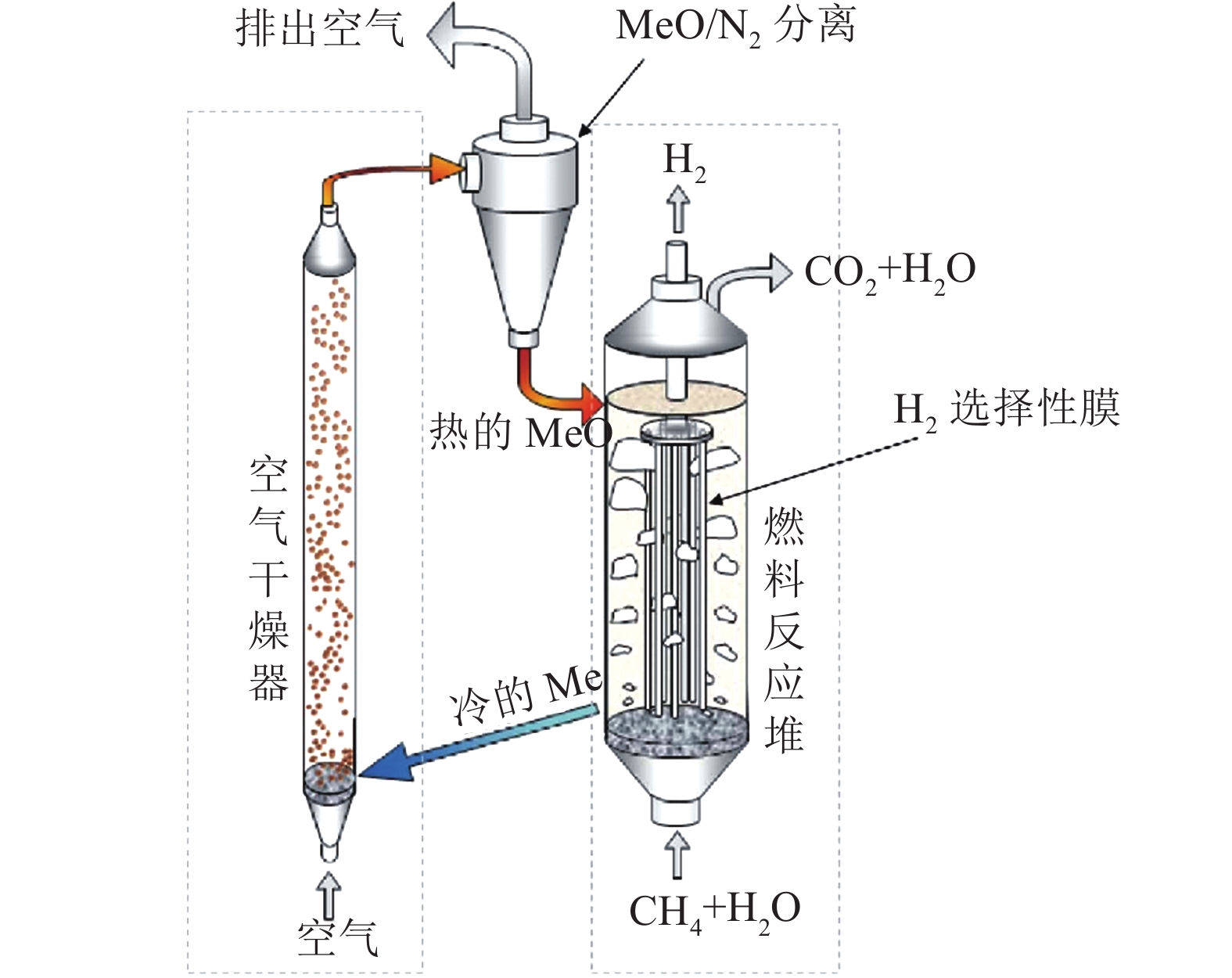
经过多年的发展,化学链重整直接制氢技术一般采用流化氧离子载体的设计形式[15],如图4所示。
固体氧离子载体(MeO)在流化状态下,间歇性的引入重整器,与碳氢燃料、水反应,同时伴随氧离子载体化学态与温度状态的间歇性改变(MeOMe),通过外界的空气的氧化实现载体的再生(MeMeO), 配合选择性透氢膜在重整器内实现氢的提纯,有效提升重整效率,同时,其排放的CO2浓度高且不与H2产品掺混,易于收集,能够获得高纯度的氢气(近零能耗分离),提升了综合制氢能量效率。目前该技术同样处于商业化应用的前期,面临着关键金属基氧化物材料优选开发(如氧化铈、氧化钨、氧化铁)[16-18]及化学链热力流程优化设计这两大挑战[19]。作者认为化学链重整直接制氢系统的设计应更多的提升系统热设计,可以将工业废热、地热等低品位热源作为重整器的供热源,降低外部热负荷,从而降低制氢的碳排放代价,同时对于固有的碳排放,应设计合理的碳捕捉、利用和封存手段[20],与化学链重整过程协同构建有效的热力学整合与余热回收体系(碳捕集过程耗电/耗热),进一步提升整体系统碳排放表现。
2. 主流电解水制氢技术
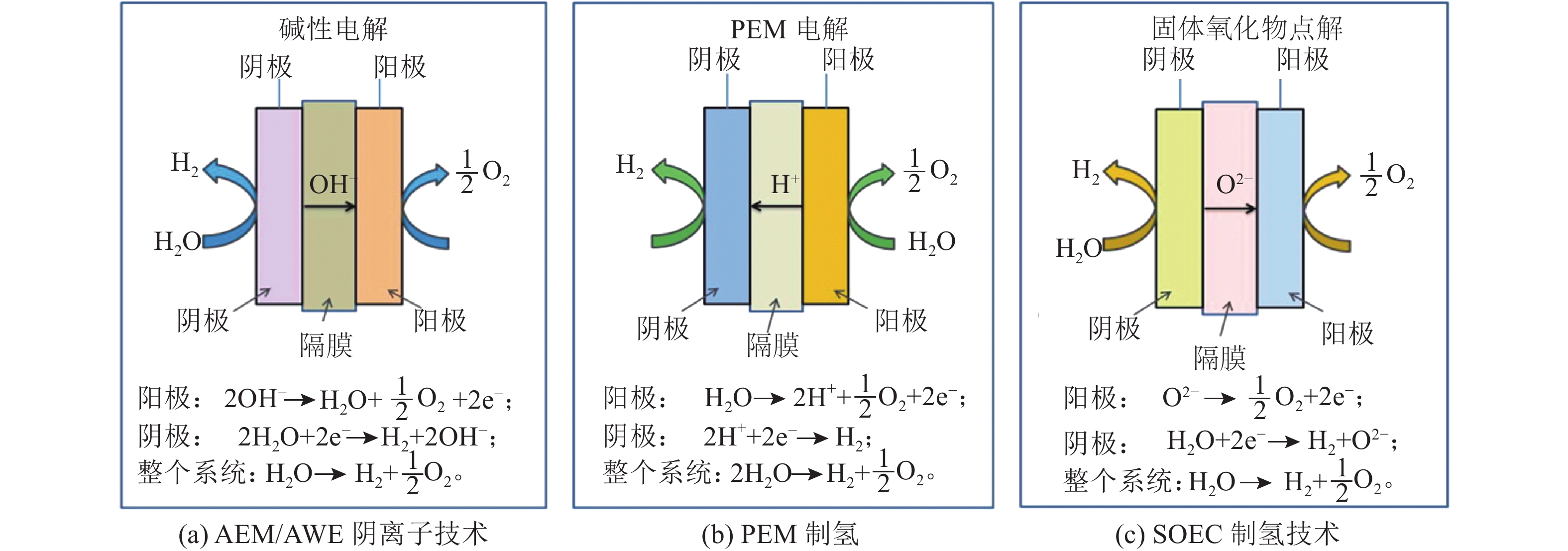
电解水的基本原理是以电能作为能量来源,推动电解质溶液中的水分子在电极上发生电化学反应,生成氢气与氧气。其中:阴极发生的是析氢半反应(hydrogen evolution reaction,HER),生成氢气;阳极发生析氧反应(oxygen evolution reaction,OER),生成氧气。目前主流电解制氢技术有4种,即碱性电解制氢(alkaline water electrolysis,AWE)、阴离子交换膜电解(anion exchange membrane electrolysis,AEM)、质子膜电解制氢(proton exchange membrane electrolysis,PEM),以及固体氧化物基电解制氢(solid oxide electrolysis cells,SOEC),其基本原理如图5所示,表2对比了技术指标[21]。
电解水制氢技术 隔膜材料 电流密度范围/
(A·cm–2)标方氢能耗/
(kW·h)温度/℃ 商业化程度 生产特征 安全性 环保性 碱性电解
制氢(AWE)30%KOH石棉膜 <0.8 4.5~5.5 ≤90 充分产业化 需控制压差,
产气需脱碱强碱易腐蚀 石棉膜
有危害性阴离子交换膜
电解(AEM)阴离子交换膜 1~2 — ≤60 实验室研发阶段 启停便捷,
产气杂质仅水蒸气强碱易腐蚀 — 质子膜电解
制氢(PEM)质子交换膜 1~4 4.0~5.0 ≤80 小规模产业化 启停便捷,
产气杂质仅水蒸气无危险物质 无污染物质 固体氧化物基
电解制氢(SOEC)固体氧化物 0.2~3.0 预期效率约为100% ≥800 尚未产业化 启停不便,
产气杂质仅水蒸气— — 其中,碱性电解制氢AWE技术无疑是目前最成熟,应用最广的制氢技术(约70%的能量效率),是大型制氢储能项目的首选技术路线。主要工作在70~90 ℃,工作压力为10个大气压~30个大气压不等,一般采用30% KOH水溶液作为电解液,以石棉、涤纶布、尼龙、陶瓷等多孔材料作为隔膜。电极材料方面,商业化的电解槽产品以镍网(布)等非贵金属为主,辅以简单的电极表面粗糙化处理或合金化,提高比表面积与活性,一定程度上降低电极的电解能耗[22]。在工程应用上,碱性电解制氢仍旧面临动态特性差、碱液腐蚀问题、压力–液位控制、串气安全问题等缺点。为克服上述缺点,研究人员近来开发出了一种阴离子交换膜AEM电解技术,即采用具有良好气密性、低电阻性、成本较低的阴离子交换膜,替代AWE中的隔膜。碱液中的OH–通过该阴离子交换膜,形成电解槽的电流回路。若优选用较薄、致密且无孔的聚合物阴离子交换膜(10~50 μm)[23],配合低成本非贵金属析氢、析氧催化剂(如Co3O4、CeO2–La2O3、Ni–Mo[24-26]),电解槽在1 mol KOH溶液就能实现高电导率(25 mS/cm、60 ℃)以及大电流密度(1.0 A/cm2、1.57 V、80 ℃),也同时缓解了AWE方案中的串气问题。作者认为AEM较低的成本优势以及较为优秀的电流密度指标将使其成为大规模制氢应用中,AWE制氢最有可能的改进方案(相对于PEM成本更低,相对于SOEC技术门槛更低,稳定性更好)。
PEM制氢则使用以全氟磺酸质子交换膜(nafion等)作为隔膜代替碱性电解的石棉膜。得益于PEM燃料电池技术的飞速发展以及空前的研究热度,PEM燃料电池的逆过程—PEM制氢亦成为制氢领域最受被看好的下一代制氢技术。
质子交换膜具有化学性质稳定、质子导电率高((0.10±0.02) S/cm)等特点,能够确保纯水在电极催化剂的作用下进行高效地水分解。与AWE与AEM制氢相比,具有更优异的能耗表现以及更大的电流密度,更高的动态响应特性,以及更高的产品气体纯度。PEM技术目前的商业化进程很快,但较为依赖铂族贵金属催化剂,并且全氟磺酸质子交换膜价格昂贵,在一定程度上阻碍了其大规模推广。
SOEC技术在电解器件设计和工作条件方面与前3种电解水制氢技术有明显区别。SOEC采用全固态的电解池设计,阴极材料选用多孔金属陶瓷Ni/YSZ,阳极材料选用钙钛矿氧化物等非贵金属催化剂,常用电解质为YSZ基氧离子导体或BZCY基质子导体,工作温度可达800 ℃以上,无需贵金属催化剂,有效降低了电解能耗。但对材料高温条件下的化学稳定性、热机械稳定性以及高温密封等有较高要求,一定程度上也限制了该制氢技术的推广和应用。因篇幅限制,上述4种主流的电解水制氢技术原理、特点,读者可参考相关文献[27]。以下将聚焦上述电解水技术近年来的新进展,进行介绍及评述。
3. 新型电解制氢技术发展
3.1 高温电解制氢新发展
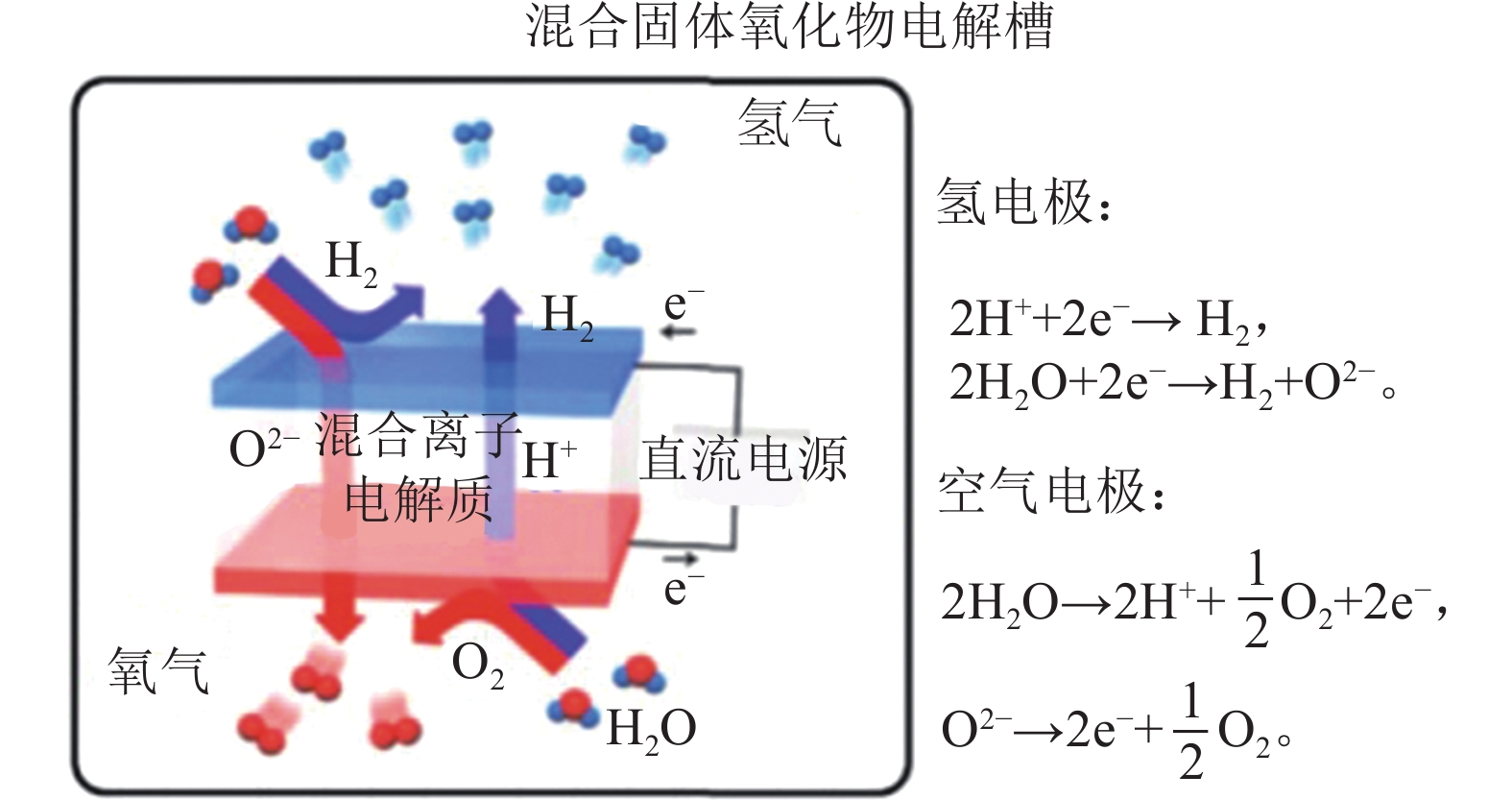
如第2节所述,SOEC技术具有效率和电流密度上的优势,但仍处于实验室研发阶段。根据SOEC电解质材料的不同,主流的SOEC 可以分为两类:基于氧离子导体电解质的SOEC(O–SOEC)和质子导体电解质的SOEC(P–SOEC),其电解制氢过程如图6所示[28]。
目前常用的O–SOEC氧离子导体电解质有钆/钐掺杂氧化铈、钇稳定氧化锆、镁锶掺杂镓酸镧等[29],技术相对成熟。而近年来,为提高SOEC的长期稳定性,SOEC中温化成为了新的发展趋势。由于P–SOEC在中温400~500 ℃范围内较高的离子导电率(相比于氧离子导体),P–SOEC因此也受到越来越多的关注。目前较为典型的质子导体基电解质多为锆酸钡、锆酸铈基氧化物等[30]。
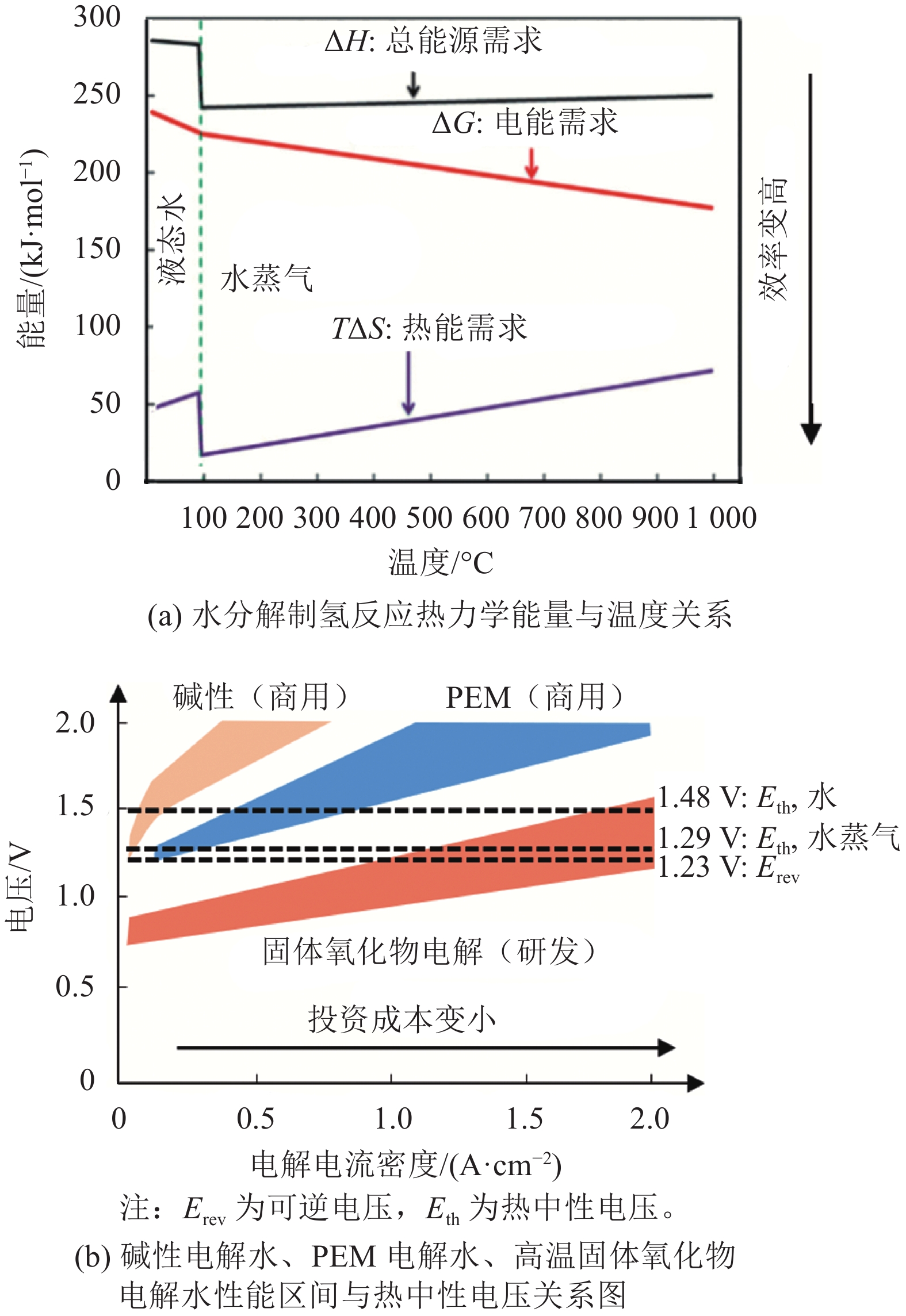
根据水分解热力学性质与温度的关系(如图7所示),高温操作条件(500~800 ℃)使电解水反应能够在热中性电压下进行[31-32]。这意味着如果制氢现场有高质量的废热源,通过合理的热回收,制氢过程所需要的总能量(焓变ΔH)可由电能(吉布斯自由能变ΔG)与热能(TΔS)共同提供,降低了电能的需求,整体电效率大大提升,可以达到甚至超过100%。此外,从动力学上,较高的操作温度也大大降低了析氧、析氢两个半反应的过电位,使高温电解制氢具有天然的高效率优势,也避免了贵金属催化剂的使用。但过高的温度也带来了对电解池器件材料的挑战(如密封等高温长期服役性能),制约了高温电解制氢的商业化推广。因此,目前该技术的发展趋势十分明确,即通过催化材料的优化开发降低电解池的操作温度,如高电导率电解池材料开发、高催化活性电解催化材料开发等[33]。最终目标是在低温(如400~500 ℃)下实现高效率的稳定电解水制氢。
近年来,研究者们亦在P–SOEC与O–SOEC范畴外提出新的思路。如Kim等[28]采用复合离子导体膜(BaZr0.1Ce0.7Y0.1Yb0.1O3–δ)作为电解质,构建了产氢、产氧的双离子通道电解质,其工作原理如图8所示,充分利用电极上的催化活性位点,有效地降低了水分解制氢的过电势,(750 ℃下电流密度可达3.16 A/cm2),同时,也展现了优异的长期稳定性(其大于60 h 无衰减)。该思路拓宽了高温电解水制氢的工作模式,对开发新型双离子导体SOEC具有借鉴意义。然而,对于其电解质母体材料BaZrCe基氧化物来说,仍旧面临着烧结与稳定性矛盾,即Ce比例越高,电导越高,但稳定性变差(尤其是在CO2与H2O氛围中),而Zr的比例越高,则稳定性变好,但烧结性越差。因此,如何引入杂原子掺杂,使保证在高质子电导率、易烧结性的前提下,引入高的氧离子电导率,同时,产生电子电导,是未来双离子导体SOEC开发中最具有挑战性的课题。
3.2 碱性电解水高温化
如3.1节所述,高温化对于提升电解过程动力学以及降低欧姆损失(即减小电解液电阻)有显著的作用。图9为电解液电导率与温度、KOH质量分数的关系,如图9所示,将传统的碱性电解池的操作温度提升,将能有效提升电解池的效率[34]。
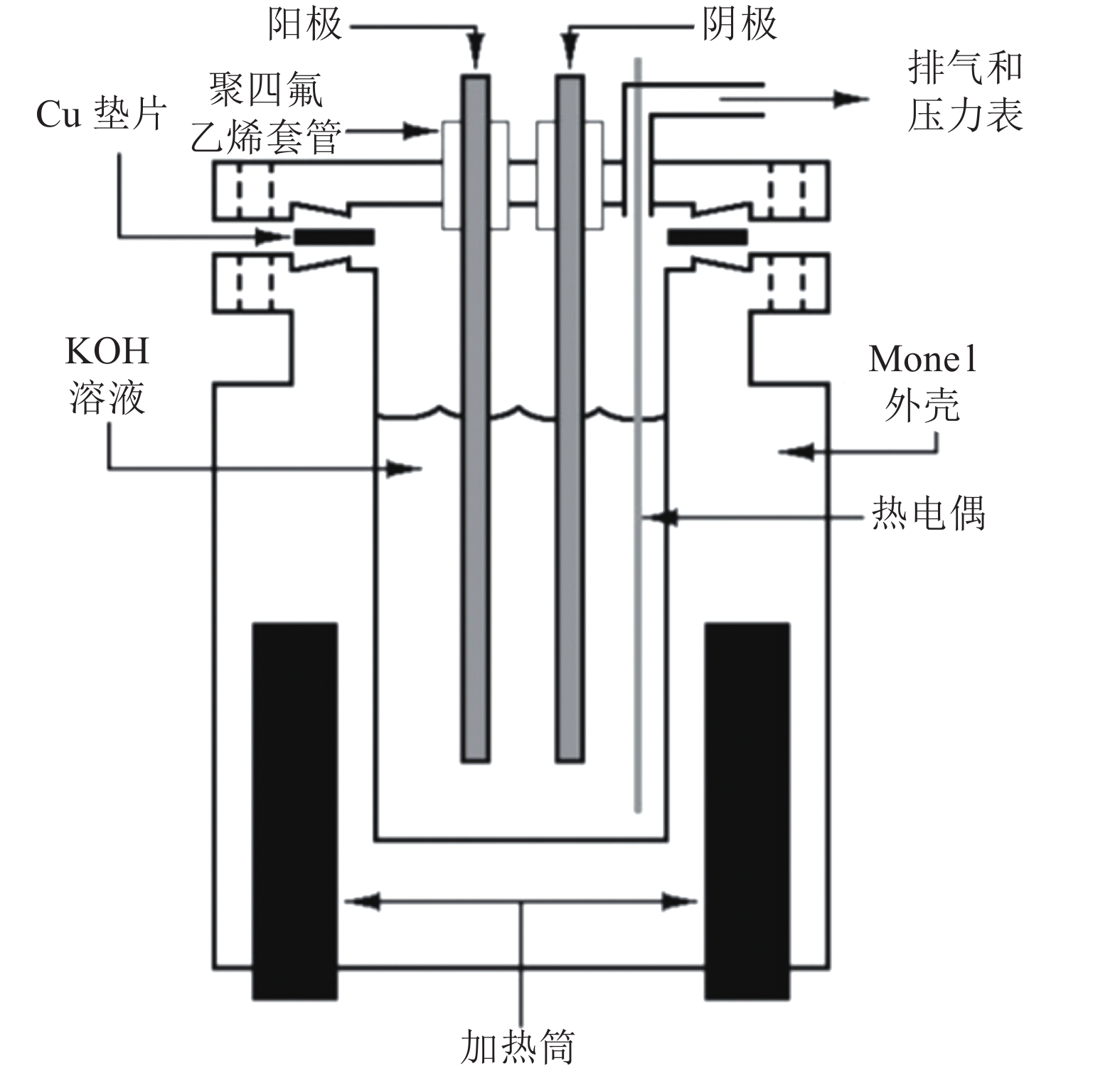
一种最简单的思路便是增加电解池内电解液的压力或增加电解液的浓度,从而降低电解液的挥发[35]。如Ganley[36]采用如图10的高压电解槽设计,实现了200~400 ℃、87个大气压条件下的碱性电解水制氢(以19 mol KOH为电解液)。由图10可知,压力和温度的增加有效降低了电解水的能耗损失,在200 ℃下,能达到 1 A/cm2的制氢电流。当然过高的温度与高的电解液浓度也带来了碱腐蚀的问题,降低了电极与电解槽体的耐久性。将传统的镍基电极材料替换为Monel alloy等耐碱腐蚀镍基合金是目前缓解该问题的有效办法。
上述高温高压的热力学设计思路不仅能有效提升电解过程的热力学效率,在相同目标电流密度下,能使电解电压接近热中性电压,从而简化系统的热管理。同时,液态高温碱性电解由于其优异的反应动力学,还能采用非贵金属基的OER和HER催化剂,相比于必须采用贵金属催化剂的PEM电解水制氢,成本能得到更好的控制[37]。
目前受制于高压操作情况下氢氧侧压力管理的难度(高压下氧气溶解度增高)与整体电解槽压力控制系统、液体管理系统的高复杂度等技术瓶颈,该加压–加温电解的思路仍旧处于实验室研发阶段。
另一种高温化的思路则是将KOH固化(图11),即通过多孔氧化物框架与KOH进行复合,前者将后者固化后,实现在高温下对碱含量的保持(维持固体电解质膜的OH–通道)[38]。多孔电解质内固液相间毛细力则是固化保持KOH的主要作用机理,同时气体扩散电极避免产生的气体将电解液带至电极内部形成气泡(避免阻碍电极气体传输),最终在1.48 V、240 ℃、37个大气压条件下,实现了1 A/cm2 的超高电流密度。
3.3 海水制氢
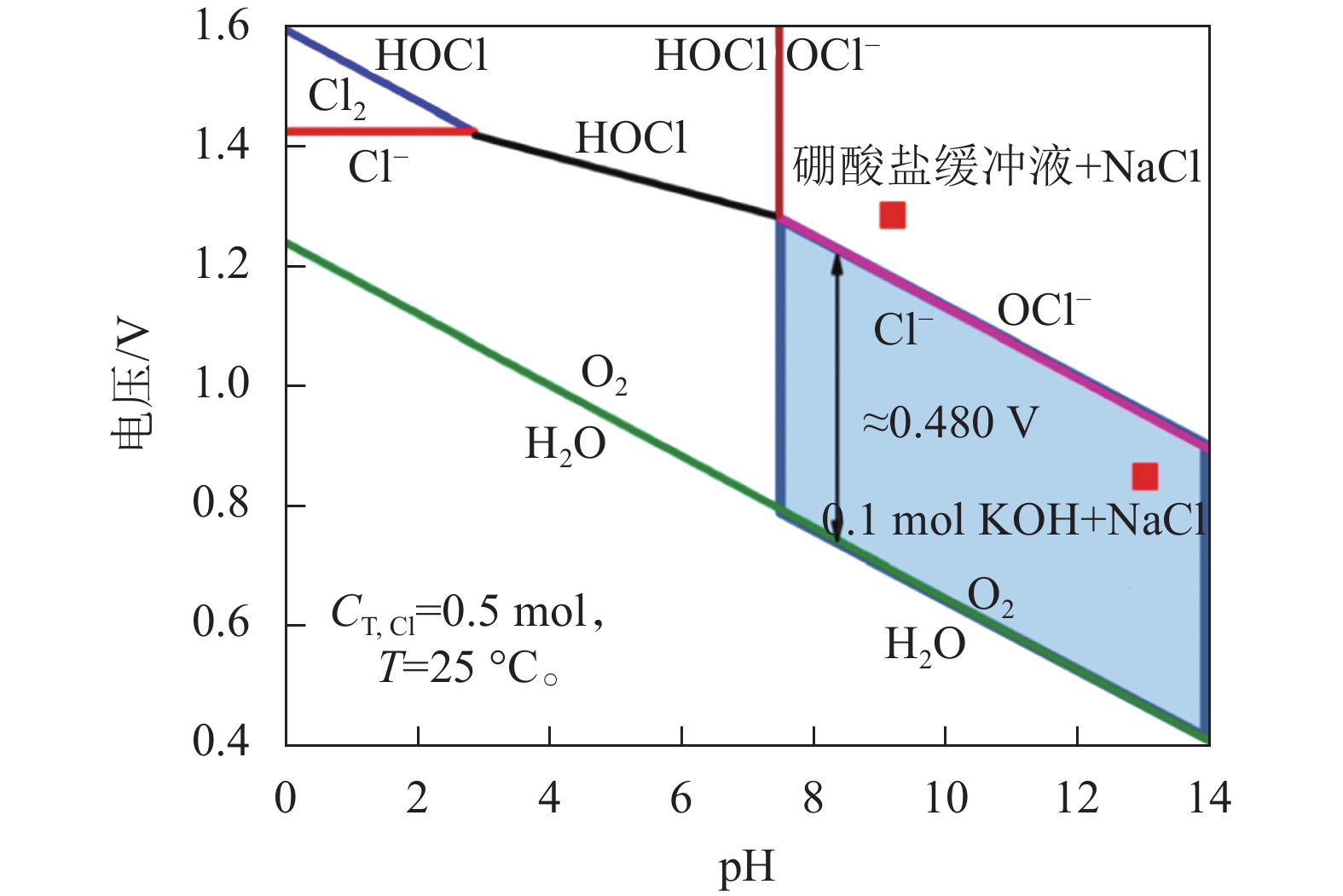
海上具有丰富的风能、太阳能等可再生能源,是可再生能源就地制氢的绝佳场所。但常用的电解水制氢技术主要采用纯水作为原料,而离岸条件下往往缺乏纯水供应,限制了海上可再生能源电解制氢的应用。若使用成分复杂的海水作为原料(全球海水平均成分[39]如表3所示),加碱后电解制氢,其中,Ca2+、Mg2+ 离子会在碱性条件下生成Mg(OH)2、Ca(OH)2沉淀,导致制氢设备堵塞、腐蚀和效率衰减。而且,海水中的高浓度的Cl−离子(平均浓度19400 mg/L,约 0.547 mol)的析氯电位与析氧电位相差不大 (以25 ℃、0.5 mol NaCl溶液作为参考,根据析氧反应与析氯反应电压计算公式(4)~(5),仅为0.48 V),其电化学Pourbaix图如图12所示[40]。
$$ 2{\text{H}}_{\text{2}}\text{O}\to {\text{O}}_{\text{2}}{\text{+4H}}^{\text+}{\text{+4e}}^{-}\text{,}{{E}}_{{{\rm{O}}}_{2}/{{\rm{H}}}_{2}{\rm{O}}}^{0}=1.229\;{\rm V} $$ (4) $$ 2{\text{Cl}}^-\to {\text{Cl}}_{\text{2}}{\text{+2e}}^{-},{{E}}_{{{\rm{Cl}}}_{2}/{{\rm{Cl}}}^-}^{0}=(1.358+0.059{\rm pH})\;{\rm V} $$ (5) 式中,
${{E}}_{{{\rm{O}}}_{2}/{{\rm{H}}}_{2}{\rm{O}}}^{0}$ 为水分解平衡电压,${{E}}_{{{\rm{Cl}}}_{2}/{{\rm{Cl}}}^-}^{0}$ 为析氯平衡电压。也就是说,在实际制氢工作电压1.8~2.0 V条件下,析氯反应将会与析氧反应竞争,降低电解的法拉第效率,同时生成高腐蚀性的OCl–离子,引发析氧电极催化剂性能的快速衰减。
因此,复杂的海水离子成分成为了制约直接海水电解制氢(加碱后电解)的关键瓶颈。现阶段海水制氢技术路线一般采用先淡化后碱性电解制氢的路线,如使用蒸馏法、反渗透和电渗析等海水淡化技术就地生产纯水。目前国内外海水电解制氢项目较多[41-43],如表4所示。总体来看,“风电平台+电解设备”的制氢方式适用于新建的海上风电场,通过在风机平台上设置水电解制氢设备实现大规模的分布式制氢,产品氢直接通过管道外送。“旧平台改装+电解设备”的制氢方式则就近在即将退役的油气平台和现有的油气管道附件建设从而降低制氢成本。“新建海上平台+电解设备”的制氢方式则适用于离岸较远的风电场,通过新建海上制氢平台,减少电力传输损耗。
项目 项目类型 开始年份 目标 主要参研机构/公司 英国Dolphyn项目 风电平台+
电解装置2016 2026年实现单机制氢 Environmental Resources Management 挪威Deep purple项目 风电平台+
电解装置2018 2025年完成海上试验,
2031年项目大规模运行TechnipFMC、The research Council of Norway JIDAI方案 新建平台
电解装置2015 认为2030年前可实现商业化 Det Norske Veritas Tractebel 方案 新建平台+
电解装置2019 开发400 MW海上风电制氢平台 Tractebel Engineering、Tractebel Ovenlick 法国Lhyfe公司方案 新建平台+
电解装置2017 2025实现海上风电制氢 Lhyfe 德国AuqaVentus项目 新建平台+
电解装置2020 2030实现10 GW海上风电制氢 Rwe 青岛深远海200万kW海上风
电融合示范风场项目新建平台+
电解装置2020 2025年实现海上风电200万kW 中能融合海上风力发电机组有限公司、
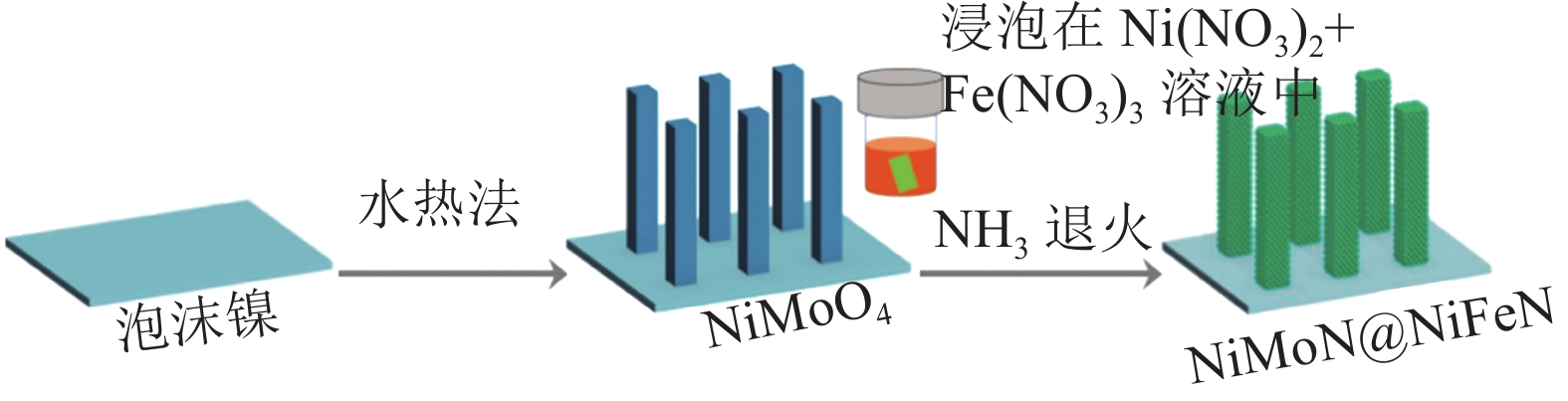
中国电建集团从海水制氢能耗与经济性的角度来评价,虽有计算表明海水淡化后电解制氢路线的淡化能耗成本并不高[44],但在离岸场景下,高昂的设备投资与安装条件还是极大的限制海上可再生能源制氢工程的实施。基于此,能够直接电解海水或加碱海水制氢的催化剂开发成为了近年的研究热点。其中,最常用的开发策略是制备具有抗氯表面功能层的析氧催化剂。如Yu等[45]通过对经典NiFe析氧催化剂做氮化处理(其实际制备过程如图13所示),有效提升了其耐氯腐蚀性与活性,所得的NiFeN 析氧催化剂在添加1 mol KOH后的碱性海水中只需要1.709 V的外加电压便能达到1000 mA/cm2 的大制氢电流,催化剂在500 mA/cm2电流密度下能够稳定工作逾100 h;并发现在析氧过程中,催化剂表面生成的无定型NiFe氧化物层及羟基NiFe能够有效抵抗析氯反应产物的腐蚀。
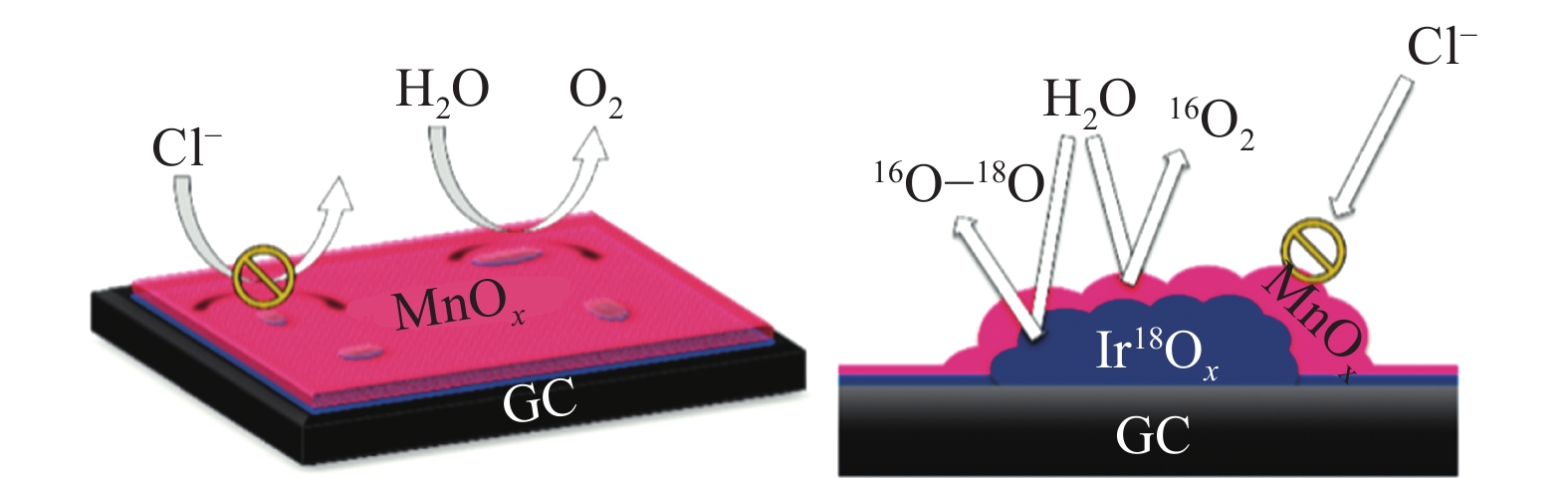
此外,MnOx亦被发现是一种有效的抗氯功能层[46]。如图14所示,Vos等[47]证明了IrO2表面的MnOx层通过阻挡Cl–向Ir 活性位点的输运,从而降低催化剂的析氯反应活性,减少了析氯反应,从而提升了催化剂在海水中的析氧表现。
类似的表面功能层还包括 Co–Bi[48]、Co–P[49]、Ni–S[50] 等,均可以有效提高海水直接电解制氢的耐氯性能。但遗憾的是,目前尚无真正的海水直接制氢工程应用示范来验证上述催化剂表面功能层的有效性。
除了添加表面功能层,另一种解决氯腐蚀的策略则更为彻底,即将析氧过程与析氢过程从时间和空间上解耦[51],具体流程如图15所示。首先,通过负载于正极上的解耦剂发生氧化半反应(如Ni(OH)2氧化成NiOOH),与析氢半反应组成一对完成电化学反应,使海水分解,获得氢气,但不发生析氧。随后断开回路,解耦剂自发还原再生,同时生成氧气,完成整个水分解过程。可以发现整个过程,原本正极上的析氧反应被替换成了解耦剂的氧化与还原,只要其氧化电位低于析氯电位,且解耦剂的还原可逆性好,电化学动力学优异,那么能极大的避免析氯。
同样思路也可以应用于析氢反应的解耦,用于解决析氢侧pH值变化时伴随的钙镁离子沉淀问题。例如,当硅钨酸作为析氢解耦剂时,其良好的电化学可逆性[52]使H2制取速率可以达到传统的PEM电解水体系30倍以上的理论制氢速率,展现出了极大的潜力。
目前该解耦式制氢思路仍旧处于实验室研究阶段,作者认为,进一步研究应该集中在解耦剂优选以及解耦电解槽的优化设计。理论上只要氧化还原电位处于析氢反应与析氧反应电位之间的氧化还原剂均可作为解耦剂,如氢醌磺酸钾、磷钼酸、多金属氧酸盐等[53],解耦制氢的整体效率很大程度上取决于解耦剂氧化还原反应的可逆性,但高可逆性一般伴随着较差的稳定性,如易氧化、高电压下易分解等情况的发生,导致制氢容量的下降。此外,由于解耦剂一般为固体,负载在电极上,如何增加单位槽体体积(或电极体积)上的解耦剂载量,提高单次解耦循环制氢量,是解耦式制氢这一技术真正应用前所要面临的另一挑战。
4. 结论与建议
在碳中和的背景下,通过开展制氢关键材料研发、器件设计优化,热力学工艺优化及系统开发等多个层次的攻关研究,开发低成本、低能耗的制氢技术路线,将能有效推动氢能的发展。本文对近期先进制氢技术的发展现状、技术特点以及优缺点进行了分析讨论,得出以下结论和建议:
1)化石制氢作为现阶段的主要制氢方法,应该着重发展低碳化的新技术、新方法,单纯的提高制氢效率与利用率无法真正解决化石燃料制氢的碳排放(灰氢),其固有的碳排放需要配合先进的碳捕集碳利用技术。
2)传统电解水技术的发展除了材料学研究(高性能催化剂研发)外,另一个有效思路是对电解制氢的热力学条件的工程优化,即选择合适的电解制氢温度以及完善相应的整体技术方案。将传统的碱性电解发展为能够在高温下(如150~200 ℃);进一步优化高温固体氧化物燃料电解制氢温度(降低至400~500 ℃);开发解耦式等海水制氢技术都是这一思路的有效实践。
3)发展氢能应充分考虑区域可再生能源资源禀赋,研究风电、太阳能等可再生能源电站与制氢流程的高效耦合对构建氢能为核心的未来能源体系具有重要作用。以广东省为例,现阶段新能源发电装机规模发展迅猛(2903万kW),同时广东省是全国海洋线长度最长的地区(4314.1 km),海水资源最为丰富。充分利用好海水资源、海上风电资源的关键在于开发具有实用价值的海水直接制氢技术。
4)目前制氢技术的大部分瓶颈在于关键核心材料开发。因此,在诸多新型水制氢技术的发展路径上,应该集中力量攻关制氢相关的能源材料基础研究。海水直接制氢的非贵金属催化剂以及解耦式海水电解的真正大规模应用,对于发展海洋氢能具有重要作用。
-
大洲 电能消耗/
PW·h装机容量/
GW可再生能源
装机/GWGDP/万亿
欧元氢能潜在市场/
万亿欧元欧洲 2.9 1055 312 15.9 2.2 美洲 3.9 1095 144 20.6 2.9 亚洲 10.4 3129 480 31.5 4.4 电解水制氢技术 隔膜材料 电流密度范围/
(A·cm–2)标方氢能耗/
(kW·h)温度/℃ 商业化程度 生产特征 安全性 环保性 碱性电解
制氢(AWE)30%KOH石棉膜 <0.8 4.5~5.5 ≤90 充分产业化 需控制压差,
产气需脱碱强碱易腐蚀 石棉膜
有危害性阴离子交换膜
电解(AEM)阴离子交换膜 1~2 — ≤60 实验室研发阶段 启停便捷,
产气杂质仅水蒸气强碱易腐蚀 — 质子膜电解
制氢(PEM)质子交换膜 1~4 4.0~5.0 ≤80 小规模产业化 启停便捷,
产气杂质仅水蒸气无危险物质 无污染物质 固体氧化物基
电解制氢(SOEC)固体氧化物 0.2~3.0 预期效率约为100% ≥800 尚未产业化 启停不便,
产气杂质仅水蒸气— — 表 3 全球表层海水平均成分浓度表(3.5%盐度)[39]
Table 3 Global average contents of surface seawater (3.5% salinity)[39]
成分 浓度/(mg·L−1) Cl– 19400 Na+ 10800 ${\rm{SO}}^{2-}_4$ 2700 Mg2+ 1300 Ca2+ 400 K+ 400 ${\rm{ HCO}}^{-}_3$ 100 Br– 70 项目 项目类型 开始年份 目标 主要参研机构/公司 英国Dolphyn项目 风电平台+
电解装置2016 2026年实现单机制氢 Environmental Resources Management 挪威Deep purple项目 风电平台+
电解装置2018 2025年完成海上试验,
2031年项目大规模运行TechnipFMC、The research Council of Norway JIDAI方案 新建平台
电解装置2015 认为2030年前可实现商业化 Det Norske Veritas Tractebel 方案 新建平台+
电解装置2019 开发400 MW海上风电制氢平台 Tractebel Engineering、Tractebel Ovenlick 法国Lhyfe公司方案 新建平台+
电解装置2017 2025实现海上风电制氢 Lhyfe 德国AuqaVentus项目 新建平台+
电解装置2020 2030实现10 GW海上风电制氢 Rwe 青岛深远海200万kW海上风
电融合示范风场项目新建平台+
电解装置2020 2025年实现海上风电200万kW 中能融合海上风力发电机组有限公司、
中国电建集团 -
[1] 张雅欣,罗荟霖,王灿.碳中和行动的国际趋势分析[J].气候变化研究进展,2021,17(1):88–97. https://www.cnki.com.cn/Article/CJFDTOTAL-QHBH202101010.htm Zhang Yaxin,Luo Huilin,Wang Can.Progress and trends of global carbon neutrality pledges[J].Climate Change Research,2021,17(1):88–97 https://www.cnki.com.cn/Article/CJFDTOTAL-QHBH202101010.htm [2] Goldman Sachs.Green hydrogen:The next transformational driver of the utilities industry[R].New York:Goldman Sachs,2020. [3] Fuel Cells and Hydrogen 2 Joint Undertaking.Hydrogen roadmap Europe:A sustainable pathway for the European energy transition[R].Charleroi:FCH 2 JU,2019. [4] 李建林,李光辉,马速良,等.碳中和目标下制氢关键技术进展及发展前景综述[J].热力发电,2021,50(6):1–8. doi: 10.19666/j.rlfd.202101002 Li Jianlin,Li Guanghui,Ma Suliang,et al.Overview of the progress and development prospects of key technologies for hydrogen production under the goal of carbon neutrality[J].Thermal Power Generation,2021,50(6):1–8 doi: 10.19666/j.rlfd.202101002 [5] 于栋,司伟.氢气成本能降到几何?新三板高端装备专题报告[R].广州:广州广证恒生证券投资咨询有限公司,2019. [6] 时智勇,王彩霞,李琼慧.“十四五” 中国海上风电发展关键问题[J].中国电力,2020,53(7):7–17. doi: 10.11930/j.issn.1004-9649.202004096 Shi Zhiyong,Wang Caixia,Li Qionghui.Key issues of China’s offshore wind power development in the “14th Five-Year Plan”[J].Electric Power,2020,53(7):7–17 doi: 10.11930/j.issn.1004-9649.202004096 [7] International Energy Agency.The future of hydrogen[R].Paris:IEA,2019. [8] 李庆勋,刘晓彤,刘克峰,等.大规模工业制氢工艺技术及其经济性比较[J].天然气化工,2015,40(1):78–82. https://www.cnki.com.cn/Article/CJFDTOTAL-TRQH201501021.htm Li Qingxun,Liu Xiaotong,Liu Kefeng,et al.Technical and economic analysis for large-scale industrial hydrogen production[J].Natural Gas Chemical Industry,2015,40(1):78–82 https://www.cnki.com.cn/Article/CJFDTOTAL-TRQH201501021.htm [9] 胡久彪,余长林,周晓春.甲烷部分氧化催化剂上的积碳研究进展[J].有色金属科学与工程,2012,3(2):5–11. doi: 10.13264/j.cnki.ysjskx.2012.02.006 Hu Jiubiao,Yu Changlin,Zhou Xiaochun.Research progress of carbon deposition on catalysts during the partial oxidation of methane[J].Nonferrous Metals Science and Engineering,2012,3(2):5–11 doi: 10.13264/j.cnki.ysjskx.2012.02.006 [10] Wismann S T,Engbæk J S,Vendelbo S B,et al.Electrified methane reforming:A compact approach to greener industrial hydrogen production[J].Science,2019,364(6442):756–759. doi: 10.1126/science.aaw8775 [11] Qadrdan M,Abeysekera M,Chaudry M,et al.Role of power-to-gas in an integrated gas and electricity system in Great Britain[J].International Journal of Hydrogen Energy,2015,40(17):5763–5775. doi: 10.1016/j.ijhydene.2015.03.004 [12] 黄格省,李锦山,魏寿祥,等.化石原料制氢技术发展现状与经济性分析[J].化工进展,2019,38(12):5217–5224. doi: 10.16085/j.issn.1000-6613.2019-1088 Huang Gesheng,Li Jinshan,Wei Shouxiang,et al.Status and economic analysis of hydrogen production technology from fossil raw materials[J].Chemical Industry and Engineering Progress,2019,38(12):5217–5224 doi: 10.16085/j.issn.1000-6613.2019-1088 [13] Adanez J,Abad A,Garcia–Labiano F,et al.Progress in chemical-looping combustion and reforming technologies[J].Progress in Energy and Combustion Science,2012,38(2):215–282. doi: 10.1016/j.pecs.2011.09.001 [14] Messerschmitt A.Process of Producing Hydrogen:US971206[P].1910−09−27. [15] Medrano J A,Potdar I,Melendez J,et al.The membrane-assisted chemical looping reforming concept for efficient H2 production with inherent CO2 capture:Experimental demonstration and model validation[J].Applied Energy,2018,215:75–86. doi: 10.1016/j.apenergy.2018.01.087 [16] Gupta A,Hegde M S,Priolkar K R,et al.Structural investigation of activated lattice oxygen in Ce1–xSnxO2 and Ce1–x–ySnxPdyO2–δ by EXAFS and DFT calculation[J].Chemistry of Materials,2009,21(24):5836–5847. doi: 10.1021/cm902466p [17] Kodama T,Ohtake H,Matsumoto S,et al.Thermochemical methane reforming using a reactive WO3/W redox system[J].Energy,2000,25(5):411–425. doi: 10.1016/S0360-5442(99)00084-5 [18] Feng Yuchuan,Wang Nana,Guo Xin,et al.Dopant screening of modified Fe2O3 oxygen carriers in chemical looping hydrogen production[J].Fuel,2020,262:116489. doi: 10.1016/j.fuel.2019.116489 [19] 曾亮,巩金龙.化学链重整直接制氢技术进展[J].化工学报,2015,66(8):2854–2862. doi: 10.11949/j.issn.0438-1157.20150810 Zeng Liang,Gong Jinlong.Advances in chemical looping reforming for direct hydrogen production[J].CIESC Journal,2015,66(8):2854–2862 doi: 10.11949/j.issn.0438-1157.20150810 [20] Cormos C C.Hydrogen production from fossil fuels with carbon capture and storage based on chemical looping systems[J].International Journal of Hydrogen Energy,2011,36(10):5960–5971. doi: 10.1016/j.ijhydene.2011.01.170 [21] Kumar S S,Himabindu V.Hydrogen production by PEM water electrolysis—A review[J].Materials Science for Energy Technologies,2019,2(3):442–454. doi: https://www.sciencedirect.com/science/article/pii/S2589299119300035#b0300 [22] Lessing P.Materials for water electrolysis cells[M]//Materials for the Hydrogen Economy.Boca Raton:CRC Press,2007:37–59. [23] Vincent I.Hydrogen production by water electrolysis with an ultrathin anion-exchange membrane(AEM)[J].International Journal of Electrochemical Science,2018:11347–11358. doi: 10.20964/2018.12.84 [24] Vincent I,Bessarabov D.Low cost hydrogen production by anion exchange membrane electrolysis:A review[J].Renewable and Sustainable Energy Reviews,2018,81:1690–1704. doi: 10.1016/j.rser.2017.05.258 [25] Park J E,Kang S Y,Oh S H,et al.High-performance anion-exchange membrane water electrolysis[J].Electrochimica Acta,2019,295:99–106. doi: 10.1016/j.electacta.2018.10.143 [26] Chen Pengzuo,Hu Xile.High-efficiency anion exchange membrane water electrolysis employing non-noble metal catalysts[J].Advanced Energy Materials,2020,10(39):2002285. doi: 10.1002/aenm.202002285 [27] Grigoriev S A,Fateev V N,Bessarabov D G,et al.Current status,research trends,and challenges in water electrolysis science and technology[J].International Journal of Hydrogen Energy,2020,45(49):26036–26058. doi: 10.1016/j.ijhydene.2020.03.109 [28] Kim J,Jun A,Gwon O,et al.Hybrid-solid oxide electrolysis cell:A new strategy for efficient hydrogen production[J].Nano Energy,2018,44:121–126. doi: 10.1016/j.nanoen.2017.11.074 [29] Zheng Yun,Wang Jianchen,Yu Bo,et al.A review of high temperature co-electrolysis of H2O and CO2 to produce sustainable fuels using solid oxide electrolysis cells(SOECs):Advanced materials and technology[J].Chemical Society Reviews,2017,46(5):1427–1463. doi: 10.1039/c6cs00403b [30] Lei Libin,Zhang Jihao,Yuan Zhihao,et al.Progress report on proton conducting solid oxide electrolysis cells[J].Advanced Functional Materials,2019,29(37):1903805. doi: 10.1002/adfm.201903805 [31] Bi L,Boulfrad S,Traversa E.Steam electrolysis by solid oxide electrolysis cells(SOECs) with proton-conducting oxides[J].Chemical Society Reviews,2014,43(24):8255–8270. doi: 10.1039/c4cs00194j [32] Graves C,Ebbesen S D,Mogensen M,et al.Sustainable hydrocarbon fuels by recycling CO2 and H2O with renewable or nuclear energy[J].Renewable and Sustainable Energy Reviews,2011,15(1):1–23. doi: 10.1016/j.rser.2010.07.014 [33] Zhang Yuan,Knibbe R,Sunarso J,et al.Recent progress on advanced materials for solid-oxide fuel cells operating below 500 ℃[J].Advanced Materials,2017,29(48):1700132. doi: 10.1002/adma.201700132 [34] Hammoudi M,Henao C,Agbossou K,et al.New multi-physics approach for modelling and design of alkaline electrolyzers[J].International Journal of Hydrogen Energy,2012,37(19):13895–13913. doi: 10.1016/j.ijhydene.2012.07.015 [35] Washburn E W,West C J,Dorsey N E,et al.International critical tables of numerical data,physics,chemistry and technology[M].New York:McGraw–Hill Book Company,1989. [36] Ganley J C.High temperature and pressure alkaline electrolysis[J].International Journal of Hydrogen Energy,2009,34(9):3604–3611. doi: 10.1016/j.ijhydene.2009.02.083 [37] Christensen P A,Hamnett A,Linares–Moya D.Oxygen reduction and fuel oxidation in alkaline solution[J].Physical Chemistry Chemical Physics,2011,13(12):5206–5214. doi: 10.1039/c0cp02365e [38] Allebrod F,Chatzichristodoulou C,Mogensen M B.Alkaline electrolysis cell at high temperature and pressure of 250 ℃ and 42 bar[J].Journal of Power Sources,2013,229:22–31. doi: 10.1016/j.jpowsour.2012.11.105 [39] Pilson M E Q.An introduction to the chemistry of the sea[M].Cambridge:Cambridge University Press,2012. [40] Dresp S,Dionigi F,Klingenhof M,et al.Direct electrolytic splitting of seawater:Opportunities and challenges[J].ACS Energy Letters,2019,4(4):933–942. doi: 10.1021/acsenergylett.9b00220 [41] Caine D,Iliffe M,Kinsella K,et al.Dolphyn hydrogen:phase 1-final report[R].Manchester:Environmental Resources Management,2019. [42] Peters R,Vaessen J,van der Meer R.Offshore hydrogen production in the north sea enables far offshore wind development[C]//Offshore Technology Conference(OTC).Houston:Society of Petroleum Engineers,2020. [43] 吴瑾,焦文强,田倩,等.海洋氢能发展现状综述[J].科技风,2021(19):129–131. doi: 10.19392/j.cnki.1671-7341.202119058 Wu Jin,Jiao Wenqiang,Tian Qian,et al.An overview of the current state of marine hydrogen energy development[J].Technology Wind,2021(19):129–131 doi: 10.19392/j.cnki.1671-7341.202119058 [44] Hausmann J N,Schlögl R,Menezes P W,et al.Is direct seawater splitting economically meaningful?[J].Energy & Environmental Science,2021,14(7):3679–3685. doi: 10.1039/d0ee03659e [45] Yu Luo,Zhu Qing,Song Shaowei,et al.Non-noble metal-nitride based electrocatalysts for high-performance alkaline seawater electrolysis[J].Nature Communications,2019,10:1–10. doi: 10.1038/s41467-019-13092-7 [46] Okada T,Abe H,Murakami A,et al.A bilayer structure composed of Mg|Co-MnO2 deposited on a Co(OH)2 film to realize selective oxygen evolution from chloride-containing water[J].Langmuir,2020,36(19):5227–5235. doi: 10.1021/acs.langmuir.0c00547 [47] Vos J G,Wezendonk T A,Jeremiasse A W,et al.MnOx/IrOx as selective oxygen evolution electrocatalyst in acidic chloride solution[J].Journal of the American Chemical Society,2018,140(32):10270–10281. doi: 10.1021/jacs.8b05382 [48] Esswein A J,Surendranath Y,Reece S Y,et al.Highly active cobalt phosphate and borate based oxygen evolving catalysts operating in neutral and natural waters[J].Energy & Environmental Science,2011,4(2):499–504. doi: 10.1039/c0ee00518e [49] Song H J,Yoon H,Ju B,et al.Electrocatalytic selective oxygen evolution of carbon-coated Na2Co1–xFexP2O7 nanoparticles for alkaline seawater electrolysis[J].ACS Catalysis,2020,10(1):702–709. doi: 10.1021/acscatal.9b04231 [50] Kuang Yun,Kenney M J,Meng Yongtao,et al.Solar-driven,highly sustained splitting of seawater into hydrogen and oxygen fuels[J].PNAS,2019,116(14):6624–6629. doi: 10.1073/pnas.1900556116 [51] Dotan H,Landman A,Sheehan S W,et al.Decoupled hydrogen and oxygen evolution by a two-step electrochemical–chemical cycle for efficient overall water splitting[J].Nature Energy,2019,4(9):786–795. doi: 10.1038/s41560-019-0462-7 [52] Rausch B,Symes M D,Chisholm G,et al.Decoupled catalytic hydrogen evolution from a molecular metal oxide redox mediator in water splitting[J].Science,2014,345(6202):1326–1330. doi: 10.1126/science.1257443 [53] Symes M D,Cronin L.Decoupling hydrogen and oxygen evolution during electrolytic water splitting using an electron-coupled-proton buffer[J].Nature Chemistry,2013,5(5):403–409. doi: 10.1038/nchem.1621

 陈彬(1991—),男,副研究员,博士.研究方向:新能源、储能技术. Email:
陈彬(1991—),男,副研究员,博士.研究方向:新能源、储能技术. Email: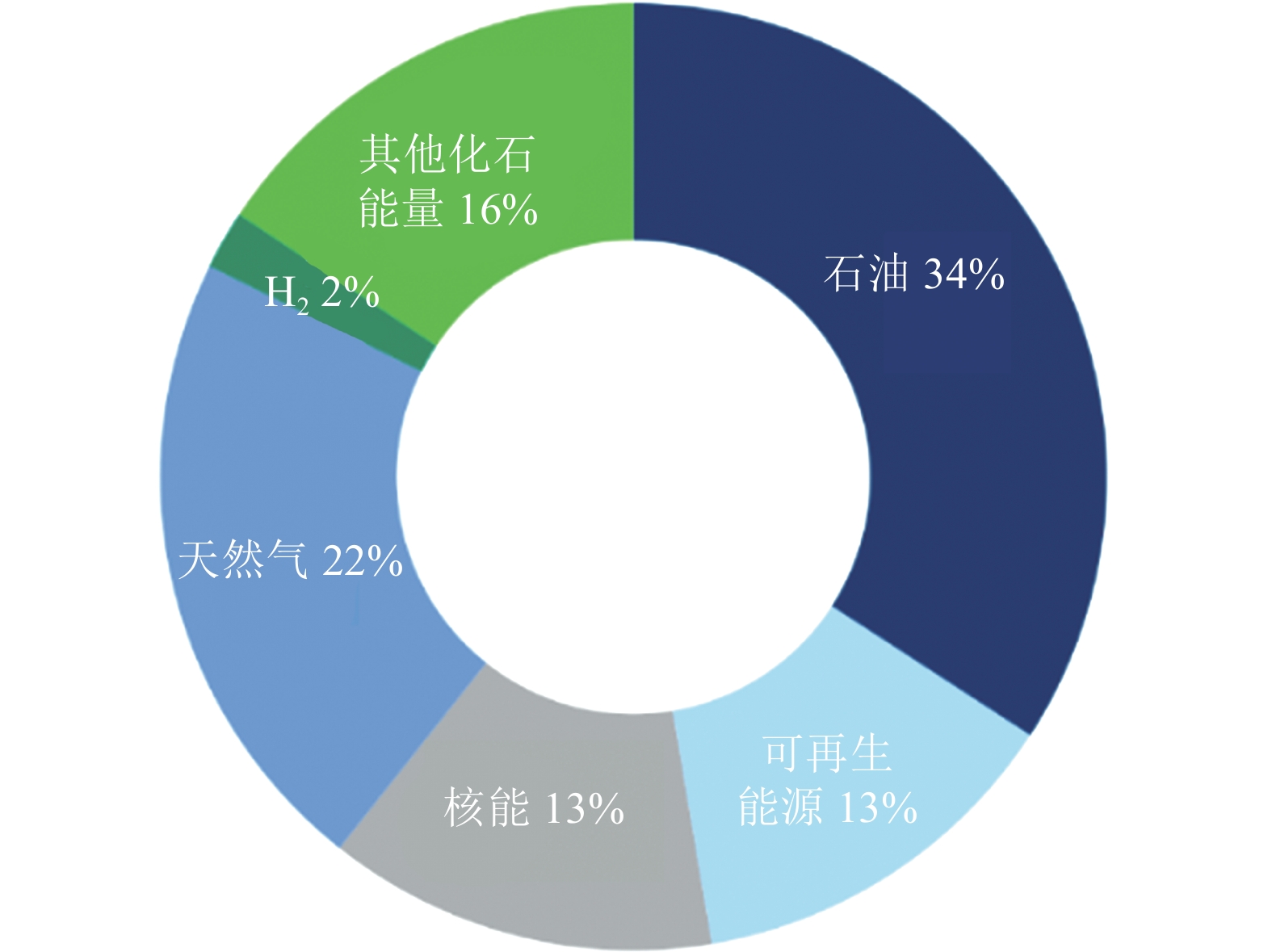
 下载:
下载: